Servicios Personalizados
Indicadores, links relacionados.

Revista alergia México
Versión on-line issn 2448-9190, rev. alerg. méx. vol.65 no.2 ciudad de méxico abr./jun. 2018, https://doi.org/10.29262/ram.v65i2.376 .
Metodología de la investigación
Estudios experimentales: diseños de investigación para la evaluación de intervenciones en la clínica
Experimental studies: research designs for the evaluation of interventions in clinical settings

1 Instituto Mexicano del Seguro Social, Centro Médico Nacional Siglo XXI, Hospital de Pediatría, Ciudad de México, México
2 Instituto Mexicano del Seguro Social, Centro Médico Nacional Siglo XXI, Hospital de Cardiología, Ciudad de México, México
3 Instituto Mexicano del Seguro Social, Centro Médico Nacional Siglo XXI, Unidad de Investigación en Síntesis y Análisis de la Evidencia, Ciudad de México, México
Los estudios experimentales se utilizan para evaluar la eficacia y efectividad de una intervención terapéutica (farmacológica o quirúrgica), preventiva (como la vacunación o los cambios estilo de vida) o educativa (por ejemplo, taller para mejorar la calidad y la atención a la salud). Existen diferentes estudios experimentales, pero en la actualidad se reconoce que el ensayo clínico controlado y aleatorizado es el que brinda el mayor grado de evidencia. Cuando no se puede llevar a cabo este tipo de investigación se tienen disponibles los estudios cuasiexperimentales, en los cuales puede ser que no se realice aleatorización o no exista un grupo control, sin embargo, tienen un menor grado de validez. En este artículo se describe la forma de realizar los diferentes tipos de ensayo clínico controlado y aleatorizado y estudios cuasiexperimentales; también se exponen sus ventajas y desventajas.
Palabras clave: Estudio experimental; Ensayo clínico controlado y aleatorizado; Estudio cuasiexperimental
Experimental studies are used to assess the efficacy and effectiveness of therapeutic (pharmacological or surgical), preventive (such as vaccination or lifestyle changes) or educational interventions (e.g., workshops to improve quality and healthcare). There are different experimental studies but, currently, randomized controlled trial (RCT) is recognized as the type of study that provides the highest level of evidence. When this type of research cannot be carried out, there are quasi-experimental studies, where there may be no randomization or a control group; however, this type of studies has a lower degree of validity. This article describes the way different types of RCT and quasi-experimental studies are performed; their advantages and disadvantages are also explained.
Key words: Experimental study; Randomized controlled trial; Quasi-experimental study
Abreviaturas y siglas
ECC, ensayo clínico controlado y aleatorizado
Antecedentes
Los estudios experimentales son un grupo de diseños de investigación que se usan generalmente para evaluar alguna medida terapéutica; sin embargo, con estos diseños también se evalúan otro tipo de intervenciones. Como intervención(es) en el área clínica nos referimos a la(s) acción(es) dirigida(s) a modificar uno o más condiciones de un paciente o sujeto sano, de manera individual o grupal.
Además de las intervenciones terapéuticas, existen las intervenciones preventivas y educativas. Las terapéuticas están dirigidas a mejorar, eliminar o a controlar un padecimiento o alguna sintomatología en particular, pudiendo ser farmacológicas, quirúrgicas, de rehabilitación y cambios en estilo de vida (alimentación, ejercicio, etcétera). En tanto, las preventivas tienen como propósito evitar la aparición de una enfermedad o el desarrollo de alguna complicación, como la vacunación y los cambios en el estilo de vida. Las intervenciones educativas pueden estar dirigidas a pacientes o a integrantes del equipo de salud y, en términos generales, con este tipo de intervenciones se pretende que las personas hagan cambios en sus conductas, hábitos o costumbres para mejorar la salud, mediante la adquisición de conocimientos. Por ejemplo, la intervención puede ser un taller para la implementación de guías en pasantes de medicina, cuyo objetivo es mejorar la calidad de atención de pacientes con asma en un primer nivel de atención.
El término eficacia es el que habitualmente se utiliza para determinar que una intervención sirve (por ejemplo, si albuterol mejora la capacidad respiratoria en pacientes asmáticos). Para establecer la eficacia de una intervención se debe realizar un estudio experimental (o ensayo clínico), en el cual a un grupo de pacientes se otorga dicha intervención (denominado grupo experimental) y se compara con otro grupo (denominado grupo control), al cual se le da un placebo o nada. Mientras que el término efectividad se utiliza para comprobar si existe diferencia en cuanto a la eficacia de dos (o más) intervenciones, es decir, son ensayos clínicos después de haber comprobado que las dos intervenciones sirven en estudios de eficacia (por ejemplo, beclometasona versus budesonida en el tratamiento de asma). Entonces, para demostrar la eficacia y efectividad de una intervención, en el grupo experimental debe existir mayor número de pacientes que se mejoran, en comparación al grupo control.
Si bien, el ensayo clínico controlado y aleatorizado (ECCA) es el diseño de investigación ideal para la evaluación de la eficacia y efectividad de las intervenciones, desde hace años se disponen de otros tipos de estudios experimentales que también pueden ayudar a comprobar la magnitud del efecto de las intervenciones, aunque con menor grado de validez. Estos estudios siguen teniendo vigencia, dado que no siempre es posible realizar ECCA. En este artículo se exponen las características de distintos diseños experimentales, incluyendo ventajas, desventajas y ejemplos.
Ensayo clínico controlado aleatorizado
Este diseño es el más riguroso para la evaluación de cualquier intervención; para llamarlo ECCA debe cumplir con cuatro características principales:
Utilizar un grupo control que permita la comparación del efecto de la intervención sobre los grupos.
La asignación de la intervención debe ser al azar (también llamado método de aleatorización) para evitar que la aplicación de la intervención dependa de los investigadores y, además, ayuda a que las características iniciales entre los grupos sean semejantes.
La medición de la(s) variable(s) de desenlace deben ser cegadas, lo cual evita sesgos de información.
Al término del estudio, la mayoría (≈ 90 %) de los participantes deben haber tenido una vigilancia completa durante todo el periodo del estudio.
El grupo control se refiere al grupo de sujetos que recibe una intervención para contrastar los resultados con el grupo experimental. En los ensayos clínicos, el uso de placebo es generalmente la intervención de control, la cual tiene una apariencia similar a la intervención en estudio, pero se trata de una sustancia inerte; se ha reportado que el uso de placebo puede provocar mejoría hasta en 40 % los pacientes en una amplia gama de condiciones clínicas, tales como dolor, asma, presión arterial alta e incluso infarto de miocardio. Cabe señalar que el grupo control no necesariamente debe ser un placebo pues en ocasiones lo más adecuado (y ético) es que sea el tratamiento estándar, es decir, la mejor alternativa terapéutica vigente en el momento de ejecutar el ensayo clínico.
En la Figura 1a se describe el proceso de un ECCA. Como se observa, para determinar la eficacia o efectividad de la intervención experimental, la variable de desenlace principal se debe medir antes y después de otorgar la intervención en los dos grupos. Si al terminar el estudio, los resultados favorecen al grupo experimental se considerará que la intervención es eficaz o efectiva.
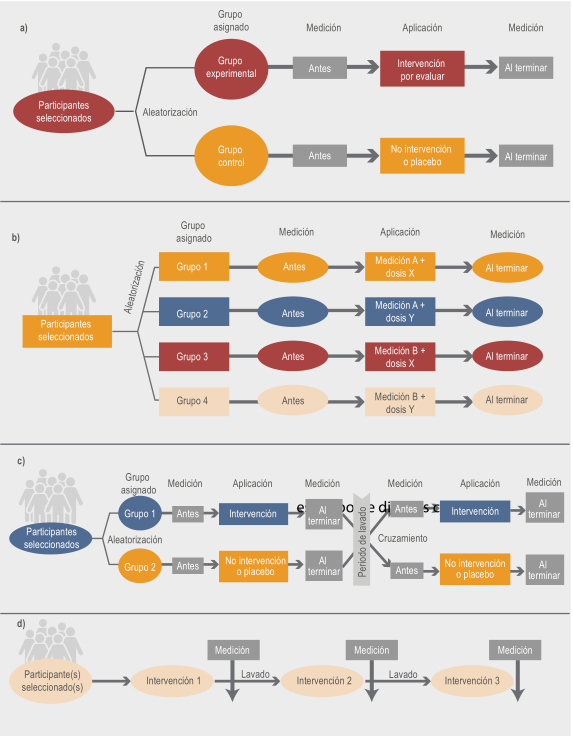
Figura 1 Tipos de ensayos clínicos controlados y aleatorizados (ECCA). a) ECCA clásico. b) ECCA factorial. c) ECCA cruzado. d) Ensayo clínico N de 1
Aleatorización
En los ECCA, la aleatorización se refiere a la probabilidad que tiene cada participante de asignarle a una u otra intervención, es decir, grupo experimental o grupo control. Así, se garantiza que el otorgamiento de la intervención no sea debido a la percepción del participante (por ejemplo, suponer que sirve el fármaco) o de los investigadores (por ejemplo, brindar el fármaco en estudio a los pacientes más graves). De hecho, desde hace años, la aleatorización es la que se considera la estrategia más importante para determinar si una intervención es eficaz o efectiva.
Además, la aleatorización tiene otra ventaja importante: balancear las posibles variables de confusión entre el grupo experimental y el control, las cuales pueden modificar los resultados de la investigación. Cuando se logra que la frecuencia y distribución de las diferentes variables sean similares entre los dos grupos, los resultados del estudio serán más confiables. De tal forma que si los resultados arrojan que el grupo experimental tuvo mayor beneficio se puede asumir que dicha intervención es la directamente responsable de modificar el curso de la enfermedad.
Existen diferentes tipos de aleatorización, los cuales no alteran la esencia de lo ya señalado y generalmente se utilizan para hacer más eficiente el estudio. La aleatorización simple es la forma más frecuente y puede realizarse de diversas maneras: echar una moneda al aire, haciendo una rifa o tómbola en la cual cada participante toma un papel que indica el grupo que corresponde. También puede ser mediante tablas de números aleatorios o con programas estadísticos.
Otra forma es la aleatorización por bloques , que consiste dividir el total de la muestra y hacer pequeños “sorteos” de aleatorización simple. Por ejemplo, si se pretende hacer una investigación con 100 participantes (50 por grupo), entonces se pueden hacer cinco bloques de 20, sorteando 10 para el grupo experimental y 10 para al control. La ventaja de esta modalidad es que al término de cada “bloque” siempre habrá un número igual de participantes de los dos grupos. En el caso de la aleatorización estratificada tiene por objetivo disminuir las variables de confusión; por ejemplo, puede ocurrir que haya diferencias de resultados entre hombres y mujeres, si es el caso, se deberán sortear un grupo experimental y otro control con cada estrato de hombres y de mujeres. De esta manera, al final habrá cuatro grupos. La desventaja principal de la aleatorización estratificada es el incremento del tamaño de muestra.
Es una estrategia establecida por el investigador para que la evaluación de los resultados sea objetiva, particularmente cuando la variable de resultado principal se mide con datos que dependen de la percepción del paciente (como dolor, efectos adversos, calidad de vida, etcétera) o de la participación del equipo de salud (identificación de signos y síntomas, como dificultad respiratoria, medición de presión arterial que pueden modificarse, entre otras cosas, por la experiencia). Sin embargo, aun cuando la variable de desenlace se mida de manera dura (como los resultados de exámenes de laboratorio), lo ideal es que todo ensayo clínico siempre sea cegado.
Cuando los participantes del estudio desconocen (es decir, están cegados) la intervención que están recibiendo (por ejemplo, fármaco activo o placebo), entonces el efecto real de la intervención será obtenido al momento de hacer la evaluación de los resultados. El propósito del cegamiento en los investigadores es para evitar una interpretación errónea cuando se realice la evaluación de la(s) variable(s) desenlace en los participantes en el estudio; por ejemplo, es posible que al conocer los pacientes del grupo del fármaco activo se realice mayor número de tomas de la variable de resultado cuando no parece haber efecto terapéutico, o bien, puede ocurrir que en el grupo control se lleven a cabo otras maniobras (conocidas como cointervenciones), a fin de proteger a los pacientes, si se piensa que deberían recibir otro tratamiento.
Como puede haber combinaciones, existen dos tipos de estudios: ciego simple o doble ciego. Si el paciente o el investigador están cegados, será ciego simple; mientras que cuando ambos están cegados el estudio se considera doble ciego. Cuando no se lleva a cabo algún tipo de cegamiento, el diseño de investigación se deberá nombrar como ECCA abierto .
Vigilancia o seguimiento de participantes durante el estudio
El mejor ensayo clínico es aquel donde todos los participantes que se incluyeron al inicio del estudio lo terminan. Sin embargo, es común observar que, por diferentes razones, al final del estudio haya menor número de participantes. Las razones de las llamadas pérdidas durante el seguimiento pueden ser por fallecimiento, cambio de domicilio, falta de apego o abandono al tratamiento, eventos adversos graves, etcétera. Desde hace tiempo se considera que una pérdida no mayor de 10 % de participantes a lo largo de la ejecución del estudio puede no afectar los resultados, no obstante, siempre se deberá conocer las causas por las que los participantes decidieron o no les fue posible continuar hasta el término del estudio.
Cuando ocurren pérdidas, los análisis estadísticos se pueden hacer de dos formas: por protocolo o por intención a tratar. El primero se refiere a que serán incluidos en el análisis exclusivamente los sujetos que cumplieron los criterios de selección, en quienes se aplicó la intervención y hubo la vigilancia de acuerdo con lo planeado originalmente. Hacer el análisis de esta forma puede ser apropiado, pero se tiene que tomar en cuenta que generalmente los resultados hacen parecer a la intervención experimental mucho mejor de lo que es real. Por su parte, en el análisis por intención a tratar, a fin de evitar que las inferencias que se realizan cuando es por protocolo, se incluye a todos los participantes, independientemente de que no hayan completado el periodo de estudio. A los participantes que no completaron el estudio se les “asigna” el peor resultado posible de la variable de desenlace evaluada; de esta forma se podrá amortiguar lo observado en el análisis por protocolo. Si con el análisis de intención a tratar los resultados muestran ventajas de la intervención experimental sobre el grupo control, entonces las conclusiones apoyarán con mayor solidez que dicha intervención es efectiva.
Ensayo clínico aleatorizado factorial
En este diseño se evalúan más de dos intervenciones. Teóricamente el diseño puede expandir el número de intervenciones, sin embargo, en los ensayos clínicos usualmente este número siempre es bajo. Por ejemplo, si se desea probar la eficacia del medicamento A comparándolo con el medicamento B, pero tomando en cuenta dos diferentes dosis de cada medicamento (dosis X y dosis Y), entonces se requerirá conformar cuatro grupos:
Con el medicamento A y dosis X.
Con medicamento A y dosis Y.
Con medicamento B y dosis X.
Con medicamento B y dosis Y.
La utilidad de este tipo de diseño es analizar la interacción del efecto de más de dos intervenciones que se incluyen en el estudio. Como se observa en la Figura 1b , con excepción del número de intervenciones, no hay variación del resto del diseño de un ECCA simple.
Ensayo clínico aleatorizado cruzado
En el ECCA de diseño cruzado los dos grupos reciben dos tratamientos o intervenciones en diferentes momentos. Como se observa en la Figura 1c , el grupo 1 recibe el tratamiento A y el grupo 2 recibe el tratamiento B por un periodo de tiempo, posteriormente se hace un periodo de lavado , donde los grupos dejan de recibir los tratamientos a fin de que la segunda parte del estudio sea semejante al momento de inicio del estudio; es decir, sin el efecto terapéutico de algún fármaco.
Posteriormente, el grupo 1 recibe el tratamiento B y el grupo 2 recibe el tratamiento A por el mismo tiempo que habían recibido el tratamiento previo. Como se describe en la figura, la medición de la variable de desenlace se realiza antes y después de la aplicación de una u otra intervención.
Este tipo de diseño es particularmente útil cuando se quiere comprobar la posible diferencia entre dos tratamientos cuya eficacia se conoce. Asimismo, solamente pueden ser realizados en poblaciones con una enfermedad estable (como hipertensión arterial o asma), ya que al término de cada intervención los pacientes deberán regresar a su estado basal. Es como hacer dos ECCA en un mismo grupo de pacientes, en dos periodos de tiempo diferente. Una de las principales ventajas es que se duplica el tamaño de muestra, puesto que todos los pacientes recibirán las dos intervenciones. Sin embargo, el tiempo de duración del estudio se duplica, lo cual puede incrementar los costos y la probabilidad de pérdidas. Asimismo, se debe tener en cuenta que, en el caso de intervenciones educativas o medicamentos poco conocidos, el periodo de lavado puede ser insuficiente, lo que impedirá obtener resultados confiables.
Ensayo clínico N de 1
Una variante de los ensayos cruzados es el N de 1. En este tipo de estudios solo existe un paciente con una condición crónica, pero con dos o más alternativas terapéuticas, siendo el mismo sujeto su propio control. Como se muestra en la Figura 1d hay tres intervenciones, las cuales se brindarán a periodos similares de tiempo. Entre cada una deberá haber medición de la(s) variable(s) desenlace, idealmente un periodo de lavado. Como también es un ECCA, pero únicamente con un participante, entonces la aleatorización será el momento de brindar cualquiera de las tres intervenciones. Por ejemplo, las secuencias de las intervenciones pueden ser: 1-2-3, 3-1-2 o 2-3-1. La desventaja consisten en que puede ocurrir un efecto de aprendizaje del participante en el estudio, además del efecto acumulado tras recibir múltiples medicamentos durante las etapas del estudio.
Diseños cuasiexperimentales
En el área de la salud para la evaluación de intervenciones, en muchas ocasiones no se pueden realizar ECCA por diferentes razones: tiempo, costos, razones éticas, la falta de deseo de los participantes. Cuando esto ocurre, la alternativa puede ser un estudio cuasiexperimental o casi experimento, cuya característica principal es que la asignación a la(s) intervención(es) no es aleatoria, pero también puede ser por la falta de un grupo de comparación, o por ambas situaciones. Si bien, ambas situaciones llevan a considerar menor grado de validez, estos diseños pueden tener ciertas fortalezas:
Requieren menor tiempo por la falta de un proceso menos riguroso de selección de participantes y porque es posible que los tiempos para medir los desenlaces sean más cortos.
Recrean un ambiente natural dado el investigador no siempre tiene la capacidad para seleccionar a los sujetos de investigación.
Son más baratos pues los costos se reducen al carecer de un grupo control o que se le otorgue placebo y también porque no hay control tan estricto en cuanto a la selección de los participantes y la medición de las variables de resultado.
Pueden aplicarse en ámbitos sociales, en virtud de que los investigadores pueden evaluar tratamientos ya establecidos.
Las desventajas son las siguientes:
Asociaciones espurias : la incapacidad del investigador para controlar a priori (en los criterios de selección) todas las variables, lo que impide demostrar de forma válida que la intervención evaluada es la única responsable del resultado de interés.
Vigilancia : el número y tiempo en el que se realizan las mediciones para determinar el efecto de la intervención sobre la(s) variable(s) de desenlace pueden ser insuficientes para demostrar resultados contundentes. Al respecto, quienes optan por realizar este tipo de estudios deberían procurar que la medición de la variable de resultado sea cegada.
En la actualidad se conoce una gama de estudios cuasiexperimentales; los más conocidos se describen a continuación:
Cuasiexperimento con grupo control no equivalente
En este diseño existe el grupo experimental que recibe la intervención por evaluar, el cual se compara con un grupo control; debido a que ningún participante fue seleccionado de manera aleatoria es posible que ambos grupos sean distintos entre sí al inicio de la aplicación de la intervención. De esta forma, es posible que en los grupos existan diferencias, por ejemplo, ser poblaciones diferentes, con distintos grados de gravedad de la enfermedad, o bien, con una variante particular de la enfermedad por estudiar en uno de los dos grupos ( Figura 2a ).
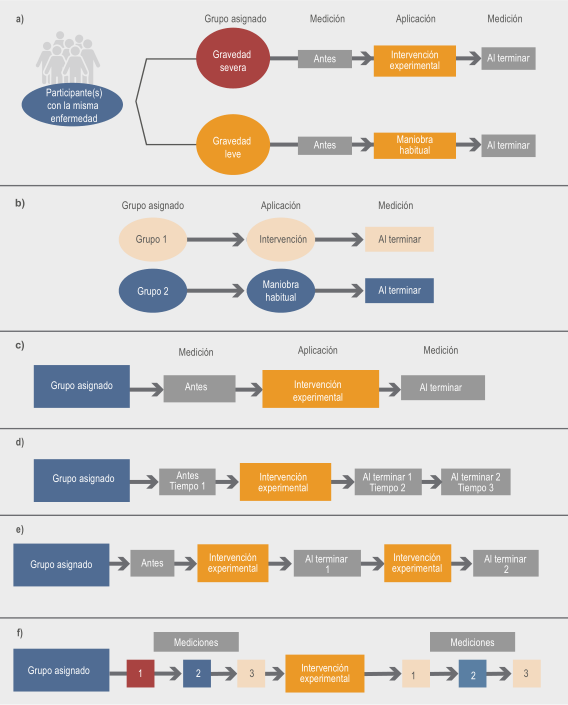
Figura 2 Tipos de estudios cuasiexperimentales. a) Cuasiexperimento con grupo de control no equivalente. b) Cuasiexperimento con grupo control no equivalente, con evaluación solo después de la intervención. c) Cuasiexperimento de un grupo, antes y después. d) Cuasiexperimento de series temporales de medidas repetidas; e) Cuasiexperimento de series temporales de dos intervenciones. f) Cuasiexperimento de series temporales interrumpidas
Por otro lado, la medición de la variable de resultado puede ser antes y después de la maniobra ( Figura 2a ) o también solo después de la intervención, como se muestra en la Figura 2b . Las pruebas estadísticas empleadas se encaminan a demostrar si existe diferencia entre ambos grupos en el momento específico, en el cual se evalúan las variables de resultado. Sin embargo, los resultados del estudio tendrán mayor validez cuando se analiza(n) la(s) variable(s) de desenlace antes y después de aplicar la intervención, puesto que para comprobar que la intervención experimental es efectiva debe demostrarse cambio favorable en la variable de desenlace después de su aplicación.
Cuasiexperimento de antes y después en un solo grupo
En la Figura 2c se describe uno de los diseños más básicos, en el cual se evalúa la intervención en estudio en un solo grupo de pacientes. Para determinar si dicha intervención puede ser útil, entonces la variable de desenlace se mide antes y después de aplicarla. Se confirma la efectividad al observar mejoría en la variable de desenlace, es decir, después de la intervención se identifica modificación de los datos basales. El problema fundamental de este diseño es que no se puede establecer con certeza si la intervención sirve, ya que al no existir un grupo de comparación es posible que los cambios observados se deban a otros factores del ambiente o del propio participante en el estudio.
Cuasiexperimentos de medidas repetidas
Mediante múltiples registros del mismo grupo de pacientes a través del tiempo, los investigadores pueden analizar cambios tras la aplicación de una intervención. Este diseño es muy parecido al anterior, pero no solamente se miden los cambios en la variable de desenlace una vez antes y después de la maniobra experimental, sino que se realiza un mayor número de mediciones y por periodos de tiempo diferentes ( Figura 2d ). Esta variante permite estimar con mayor precisión el efecto de la maniobra, ya que es posible que los participantes regresen al estado basal después de un tiempo, o bien, continuar igual o mejorando.
En este tipo de diseños también puede evaluarse más de una intervención. Como se observa en la Figura 2e , son dos intervenciones con diferentes mediciones, pero tomando como base los resultados obtenidos de la variable de desenlace antes de la aplicación de la primera intervención.
Cuasiexperimento de series temporales
En este diseño, el tiempo es la variable independiente principal donde se hacen mediciones por periodos de tiempo (iguales o diferentes) de la(s) variable(s) de desenlace, antes y después de la aplicación de la intervención experimental. También pueden ser series temporales interrumpidas en las que se puede medir el efecto de una maniobra después de interrumpir su uso ( Figura 2f ), ya sea cambiando de tratamiento o dejando de otorgarlo.
Estos diseños son de utilidad en estudios donde se desea evaluar maniobras educativas o cambios en el comportamiento de comunidades o individuos, tras implementar nuevas las políticas de salud en la búsqueda de mejorar la calidad de atención.
Conclusiones
En la actualidad el ensayo clínico controlado y aleatorizado es el diseño de investigación que aporta la mejor evidencia para determinar si una intervención terapéutica, preventiva o educativa es eficaz o efectiva. Cuando no es posible su realización se tienen disponibles los estudios cuasiexperimentales, si bien tienen menor grado de validez porque les falta el proceso de aleatorización o no existe un grupo control.
Lecturas recomendadas
1. Sackett DL. Explanatory and pragmatic clinical trials: A primer and application to a recent asthma trial. Pol Arch Med Wewn. 2011;121(7-8):259-263. [ Links ]
2. Villasís-Keever MA, Miranda-Novales MG. El protocolo de investigación II: los diseños de estudio para investigación clínica. Rev Alerg Mex. 2016;63(1):80-90. [ Links ]
3. Lazcano-Ponce E, Salazar-Martínez E, Gutiérrez-Castellano P, Ángeles-Llerenas A, Hernández-Garduño A, Viramontes JL. Ensayos clínicos aleatorizados: variantes, métodos de aleatorización, análisis, consideraciones éticas y regulación. Salud Publica Mex. 2004;46(6):559-584. Disponible en: http://www.scielo.br/pdf/spm/v46n6/22570.pdf [ Links ]
4. Hróbjartsson A, Gotzsche PC. Is the placebo powerless? An analysis of clinical trials comparing placebo with no treatment. N Engl J Med. 2001;344(21):1594-1602. DOI: 10.1056/NEJM200105243442106 [ Links ]
5. Calva-Mercado JJ. Estudios clínicos experimentales. Salud Publica Mex. 2000;42(4):349-358. DOI: 10.1590/S0036-36342000000400010 [ Links ]
6. Thorpe KE, Zwarenstein M, Oxman AD, Treweek S, Furberg CD, Altman DG, et al. A pragmatic-explanatory continuum indicator summary (PRECIS): a tool to help trial designers. J Clin Epidemiol. 2009;62(5):464-475. DOI: 10.1016/j.jclinepi.2008.12.011 [ Links ]
7. Bono-Cabré R. Diseños cuasi-experimentales y longitudinales. España: Universidad de Barcelona/Facultad de Psicología/Departamento de Metología de las Ciencias del Comportamiento; 2012. [ Links ]
8. Portney LG, Watkins MP. Foundations of clinical research. Applications to practice. USA: FA Davis Company; 2015. [ Links ]
9. Mazzucca S, Tabak RG, Pilar M, Ramsey AT, Baumann AA, Kryzer E, et al. Variation in research designs used to test the effectiveness of dissemination and implementation strategies: a review. Front Public Health. 2018;6:32. DOI: 10.3389/fpubh.2018.00032 [ Links ]
10. Lillie EO, Patay B, Diamant J, Issell B, Topol EJ, Schork NJ. The N-of-1 clinical trial: The ultimate strategy for individualizing medicine? Per Med. 2011;8(2):161-173. DOI: 10.2217/pme.11.7 [ Links ]
Este artículo debe citarse como: Zurita-Cruz JN, Márquez-González H, Miranda-Novales G, Villasís-Keever MÁ. Estudios experimentales: diseños de investigación para la evaluación de intervenciones en la clínica. Rev Alerg Mex. 2018;65(2):178-186
Recibido: 27 de Marzo de 2018; Aprobado: 04 de Abril de 2018
*Correspondencia: Miguel Ángel Villasis-Keever. [email protected]


Estudios observacionales vs. estudios experimentales
- Estudios observacionales
- Estudios experimentales
Revisiones sistemáticas y metanálisis
- Evidencia convincente
- Cuándo confiar en los estudios observacionales
- Pros y contras
Aunque los hallazgos de los últimos estudios en nutrición suelen aparecer en los titulares de las noticias y se comparten ampliamente en las redes sociales, muchos no se basan en pruebas científicas sólidas.
Sin duda, habrás notado que existen informes contradictorios sobre si un alimento es bueno o malo para la salud. Los titulares de un día dicen que tomar café es sumamente beneficioso, pero al día siguiente los nuevos titulares exclaman que el café aumenta el riesgo de ataques cardíacos.
Decir que esto puede ser confuso y frustrante es una subestimación. Muchos de nosotros nos esforzamos en elegir alimentos que mejoren nuestra salud y calidad de vida. ¿Cómo podemos saber si las últimas investigaciones presentadas son confiables?
En general, los medios de comunicación no evalúan la evidencia, sino que otorgan a los estudios conclusiones “emocionantes” para convertirlos en titulares dignos de hacer clic, sin importar cuán débil sea la evidencia.
En esta guía discutimos las diferencias entre los estudios observacionales y experimentales, las ventajas y desventajas de cada uno y por qué, en casi todos los casos, la investigación observacional no debe usarse al tomar decisiones sobre la propia dieta. Después de leer esta guía es posible que puedas identificar los informes publicados sobre ciencia nutricional que puedes ignorar de manera segura; es decir, la mayoría de ellos.
Las guías de Diet Doctor están basadas en evidencia científica, que simplificamos con códigos de colores para mostrar la evidencia sólida que proporciona un estudio: evidencia sólida, moderada, débil o muy débil: sólida , moderada , débil or evidencia muy débil. 3 Después de leer esta guía entenderás mucho mejor qué significa esto.
¿Qué es un estudio observacional?
En un estudio observacional (también conocido como estudio epidemiológico), los investigadores observan a un grupo de personas para ver qué les sucede con el tiempo. Aunque los participantes del estudio pueden responder preguntas y completar cuestionarios, los investigadores no realizan ningún experimento y no tienen control sobre los participantes.
Un estudio observacional es básicamente un ejercicio de estadística. Los investigadores intentan encontrar correlaciones entre ciertos comportamientos y ciertos resultados. Por ejemplo, las personas que comen más verduras, ¿tienen un riesgo mayor o menor de desarrollar cierta enfermedad?
Aunque las estadísticas de los estudios observacionales pueden mostrar asociaciones entre ciertos comportamientos y el desarrollo de una enfermedad o afección, estas asociaciones pueden ser, o no, relaciones de causa y efecto. 4 En la mayoría de los casos un estudio observacional no es suficiente para poder determinar esta relación. A menudo, un estudio observacional puede proporcionar una evidencia muy débil . 5 Se necesita un tipo diferente de estudio, generalmente un estudio experimental, para probar que algo es causa de algo más, por ejemplo, que tomar café puede hacer que las personas pierdan peso.
Hay buenas razones que respaldan esa famosa frase que dice que “hay tres tipos de mentiras: mentiras, mentiras malditas y estadísticas”.
¿Qué es un estudio experimental?
En un estudio experimental relacionado con la nutrición (también conocido como estudio clínico o estudio de intervención), los investigadores proporcionan a los participantes una dieta, educación sobre nutrición u otro tipo de intervención, y evalúan sus efectos.
La evidencia experimental se considera más sólida que la evidencia observacional. Los estudios controlados aleatorios (ECA) a menudo se conocen como el “estándar de oro” para la evidencia. Están diseñados para probar una intervención contra una intervención diferente (es decir, una dieta baja en carbohidratos frente a una dieta baja en grasa), o contra un grupo de control que no cambia sus comportamientos (es decir, una dieta baja en carbohidratos frente a la dieta estadounidense estándar), todo en condiciones muy controladas.
Asignar participantes al azar al grupo experimental o al grupo de control ayuda a garantizar que ambos grupos sean similares en aspectos que no se están probando (como ingresos, educación, nivel de ejercicio, etc.). Esto hace que estos estudios (en el mejor de los casos) tengan una comparación justa, y hace que la evidencia que proporcionan sea mucho más sólida: frecuentemente una evidencia moderadamente sólida .
Los mejores ECA utilizan el desarrollo real de la enfermedad en el estudio o la muerte del participante como el resultado a tomar en cuenta. Debido a que las condiciones médicas pueden tardar muchos años en desarrollarse, los ECA que duran décadas son muy costosos, lo que los hace poco prácticos en la mayoría de los casos. Por lo tanto, muchos ECA son mucho más cortos y, en lugar de medir los resultados de salud, miden los cambios en los marcadores de salud que reflejan el riesgo de enfermedad, tales como los cambios en el nivel de azúcar en sangre, la insulina o los niveles de inflamación.
Sin embargo, esto asume que los cambios en un marcador subordinado significan un impacto positivo o negativo en la salud. Como hemos visto en muchos estudios, esto no siempre es así.
Un solo estudio no es suficiente para proporcionar respuestas claras sobre la relación entre los alimentos y la salud. Las revisiones sistemáticas y los metanálisis son formas de reunir múltiples estudios en un intento de aclarar lo que dice la evidencia.
Una revisión sistemática es un proceso detallado y estandarizado de recopilación, evaluación y síntesis de una colección de estudios relevantes sobre un tema en particular.
Un metanálisis es un procedimiento estadístico para combinar los datos de los estudios utilizados en una revisión sistemática.
Las revisiones sistemáticas y los metanálisis pueden consistir en investigación observacional, investigación experimental o una combinación de ambas. Históricamente se han considerado el tipo de evidencia más sólida; sin embargo, no es siempre el caso.
Las revisiones sistemáticas y los metanálisis a veces se consideran formas de “fortalecer” los hallazgos débiles de los estudios observacionales. La idea es que, si varios estudios observacionales muestran el mismo efecto, deberían indicar una relación causa-efecto, incluso si el efecto es muy pequeño en todos los casos. Pero las revisiones sistemáticas y los metanálisis compuestos por estudios observacionales no pueden invalidar el principio fundamental de que la asociación no es causalidad. Si se tomó un placebo que no tuvo efecto para una condición a tratar, ¡no va a funcionar mejor si se toman más placebos! De la misma manera, los estudios observacionales débiles no desarrollan precisión y exactitud al combinarlos entre ellos.
Solo los ECA (estudios experimentales) pueden acercarse a establecer que un determinado alimento o forma de comer provoca un resultado particular. Las revisiones sistemáticas y los metanálisis basados en estudios experimentales tienen muchas más posibilidades de proporcionar buena evidencia que sirva para tomar buenas decisiones sobre la propia salud. La calificamos como evidencia sólida .
¿Por qué muchos estudios observacionales no proporcionan evidencia convincente?
Los estudios observacionales solo nos pueden dar información sobre cómo ciertas conductas y enfermedades están asociadas o correlacionadas. Una asociación debe ser muy sólida para indicar una posible relación de causa y efecto, e incluso asociaciones muy sólidas no necesariamente significan causalidad. Por ejemplo, el uso de faldas está fuertemente asociado con la probabilidad de desarrollo de cáncer de mama (ya que las que las usan son en su mayoría mujeres), pero sería una tontería sugerir que usar una falda causa cáncer de mama.
Típicamente, la fuerza de las asociaciones en los estudios observacionales sobre nutrición y enfermedades crónicas es pequeña, como lo reflejan los bajos riesgos relativos . Un riesgo relativo de 1.0 significa que no hay asociación. En la mayoría de los estudios observacionales sobre nutrición, el riesgo relativo es cercano a 1.0, con un rango entre 0.8 y 1.5, que indica una asociación débil. 8 Es probable que las asociaciones débiles se deban a otros factores como el azar o las variables de confusión, y no es probable que sean una relación causa-efecto.
Las razones de tales asociaciones débiles a menudo están integradas en el diseño de los estudios observacionales. Debido a que los científicos solo están observando una población seleccionada, no pueden tomar en cuenta todos los factores posibles que podrían afectar la forma en que la dieta parece estar relacionada con una enfermedad.
Por ejemplo, es probable que las personas preocupadas por su salud elijan alimentos que creen que ayudan a prevenir enfermedades. Pero también es más probable que hagan muchas otras cosas que creen que promueven y protegen su salud, como hacer ejercicio con regularidad, no fumar y tomar un multivitamínico. Es difícil saber cuál de estos factores es responsable de los resultados encontrados en un estudio observacional.
El profesor John Ioannidis es un experto de gran prestigio en metainvestigación, el estudio de las prácticas de investigación y cómo mejorarlas. En septiembre del 2018, escribió un artículo de opinión para la Revista de la Asociación Médica Americana que afirma que los estudios de observación nutricional son imperfectos y necesitan una “reforma radical” 9 En el artículo señala que no se tienen en cuenta factores ocultos que pueden sesgar los resultados de un estudio observacional (por ejemplo, las personas que comen mucha carne también pueden beber mucha cerveza y hacer poco ejercicio) y que los hallazgos se ven influenciados por el sesgo de los investigadores.
También señala el absurdo de afirmar que ciertos alimentos aumentarán la esperanza de vida por un tiempo específico. Como ejemplo, varios estudios muestran que el consumo diario de avellanas, café, naranjas y otros alimentos y bebidas puede ayudar a aumentar la esperanza de vida por varios años.
“Si obtuviéramos todos los beneficios esperados por cada uno de estos estudios, podríamos vivir por 5 mil años”, dice Ioannidis.
¿Cuándo se puede confiar en los resultados de la investigación observacional?
En otras palabras, los hallazgos de los estudios observacionales generalmente no son confiables por sí mismos.
Pros y contras de los estudios observacionales
- Son mucho menos costosos que los estudios clínicos
- Pueden durar varios años o incluso décadas
- Pueden incluir decenas de miles de participantes en el estudio
- Pueden considerar el desarrollo de una enfermedad o la muerte como un resultado
- Se basan en datos autoinformados que no se pueden confirmar
- No tienen grupo de control para la comparación
- No se pueden tener en cuenta todos los factores que pueden influir en los resultados
- No son relaciones causa y efecto
Pros y contras de los estudios experimentales
- Están estrechamente controlados y monitoreados
- Comparan los resultados entre los que reciben una intervención y los que no
- Pueden usar aleatorización para hacer frente a factores desconocidos que podrían influir en los resultados
- Son caros y consumen mucho tiempo
- Usan marcadores de salud en lugar de desarrollo de enfermedad o muerte como parámetros
- Son típicamente más pequeños que la mayoría de los estudios observacionales
- Suelen ser más cortos que la mayoría de los estudios observacionales
La investigación observacional generalmente produce resultados no confiables y estos resultados reciben más atención en los medios de la que merecen.
Antes de cambiar tu dieta según las noticias más recientes, investiga algunos datos sobre el estudio que se está discutiendo. ¿El estudio es observacional o experimental? ¿Los resultados son consistentes con investigaciones anteriores, especialmente con estudios de mayor calidad como los experimentales? Si el estudio es observacional, ¿qué tan sólidas fueron las asociaciones entre el resultado y el comportamiento, los alimentos o la dieta que se está estudiando?
Lo más importante es que recuerdes que los estudios de observación generalmente no pueden mostrar que un alimento, una dieta o un estilo de vida específicos causaron un resultado particular. Esto normalmente requiere un estudio experimental.
La conclusión es que la mayoría de los estudios de observación, y todos los titulares de los medios generados por ellos, pueden ignorarse con confianza.
¡Haz una prueba gratis por 30 días!
Obtén acceso completo a menús semanales, recetas, el programa Adelgaza de por vida , videos exclusivos y más. Verás que comer sano también puede ser delicioso.
¡Da el primer paso hacia una vida más saludable ahora!

Todos los artículos y guías por Franziska Spritzler
Franziska Spritzler es dietista titulada y educadora de diabetes certificada. Utiliza la alimentación baja en carbohidratos y el consumo de alimentos auténticos para abordar la diabetes, el control de peso corporal y la salud general.

Adele Hite, dietista
Llegué a la retórica y la comunicación desde un doctorado en epidemiología nutricional y formación en nutrición, dietética y salud pública. Me motivan las preguntas e inquietudes, muchas de las que se reducen a esto: ¿por qué la nutrición [ciencia, política, discurso] es como es?

Entendiendo el riesgo relative y absoluto
Guía Aunque parece que las cifras deberían ser objetivas y confiables, hay muchas formas de utilizarlas para distorsionar la verdad. Se han escrito libros enteros sobre este tema. Echemos un vistas a las diferencias entre el riesgo absoluto y el riesgo relativo.
Más información
La política de Diet Doctor para evaluar la evidencia científica
Guías de Diet Doctor sobre low-carb y keto
Comentarios
American Journal of Clinical Nutrition 2013: ¿Todo lo que comemos está asociado con el cáncer? Una revisión sistemática de un libro de cocina. ↩
Advances in Nutrition 2018: Limitar la dependencia de los estudios no aleatorizados y mejorar los estudios aleatorios en la investigación sobre nutrición humana: por qué y cómo.
JAMA 2018: El desafío de reformar la investigación epidemiológica nutricional
PLoS Medicine 2005: ¿Por qué la mayoría de los hallazgos publicados en investigación son falsos? ↩
Para más información sobre nuestra política para evaluar la evidencia científica haz clic en este enlace:
La política de Diet Doctor para evaluar la evidencia científica ↩
Una variable de confusión es aquella que no se tiene en cuenta en el estudio. Las variables de confusión pueden introducir sesgos e indicar una relación entre un alimento o una dieta y un resultado de salud cuando no hay uno. ↩
Sin embargo, hay excepciones:
Advances in Nutrition 2018: Limitar la dependencia de los estudios no aleatorizados y mejorar los estudios aleatorios en la investigación sobre nutrición humana: por qué y cómo. ↩
The Milbank Quarterly 2016: Producción masiva de revisiones y metanálisis redundantes, engañosos y conflictivos ↩
Se ha debatido acerca de lo que se considera una asociación “débil” frente a una “sólida” y a cuán sólida debe ser una asociación para que indique una relación causa-efecto.
Una comparación útil es que los riesgos que se encuentran en las asociaciones entre fumar y el cáncer de pulmón fueron de 10,0 para fumadores moderados y 20,0 para grandes fumadores. Este nivel de riesgo relativo fue lo suficientemente sólido como para que los expertos argumentaran una relación causa-efecto.
American Journal of Clinical Nutrition 1999: Criterios causales en epidemiología nutricional ↩
Journal of the American Medical Association 2018: El desafío de reformar la investigación epidemiológica nutricional. ↩
Durante las últimas décadas ha habido muchos casos en los que los resultados de los estudios observacionales sobre nutrición han sido contradichos por los ECA.
Significance 2011: Deming, datos y estudios observacionales: un proceso fuera de control que necesita solución
Seminarios en oncología 2010: Estudios de nutrición epidemiológicos y clínicos ↩
Para que usemos este grado de evidencia, HR debe ser sistemáticamente > 5 en varios estudios observacionales de alta calidad, con verosimilitud biológica, sin otra explicación obvia y generalmente siguiendo los criterios clásicos de Bradford Hill .
Proceedings of the Royal Society of Medicine 1965: El medio ambiente y la enfermedad: ¿asociación o causalidad? Por Sir Austin Bradford Hill ↩

- Biología
- Química
- Ecología y Medio ambiente
- Ciencias sociales
- Matemáticas
- Psicología
- Salud y enfermería
Investigación en nutrición: proceso de diseño y tipos de estudios
Asesoramiento nutricional.
” Corta los carbohidratos ”.
” Coma más fibra ”.
“Evite las grasas”.
” Come más carne ”.
“Vuélvete vegetariano”.
Parece haber muchos consejos nutricionales y muchos de ellos tienden a ser contradictorios. Puede llevarnos a preguntarnos, ” ¡¿De dónde se les ocurre esto ?! ”
Si bien puede que no haya una rima o una razón para cómo los no científicos o los empresarios interpretan los resultados, los nutricionistas profesionales desarrollan sus recomendaciones basándose en la investigación nutricional . Aprender a evaluar la investigación nutricional y sus diferentes procesos de diseño puede ayudar a alguien a determinar por sí mismo si el consejo nutricional es correcto o no.
La buena investigación nutricional sigue el método científico . El método científico sigue los siguientes pasos:
- Hacer una pregunta
- Formular una hipótesis
- Diseñar y realizar un experimento
- Analizar los resultados del experimento
- Elaborar conclusiones y compartir resultados
Diseño experimental
Hacer una buena pregunta y desarrollar la hipótesis son pasos importantes. Estos pasos deben basarse en investigaciones previas y lagunas en el conocimiento actual. Una vez que se han desarrollado estos pasos, es necesario diseñar un experimento.
En la investigación nutricional, se pueden realizar investigaciones primarias o secundarias. La investigación primaria ocurre cuando los científicos recopilan sus propios datos para analizarlos. La investigación secundaria ocurre cuando los científicos analizan los resultados de otras investigaciones y sacan conclusiones basadas en los resultados de otros investigadores. La investigación secundaria puede ser realmente importante para resumir los datos y ayudar a sacar conclusiones cuando los resultados de diferentes estudios parecen ser contradictorios. Sin embargo, normalmente los investigadores quieren centrarse en la investigación primaria.
Hay cuatro tipos principales de investigación primaria para la nutrición:
- Animal o laboratorio
- Control de caso
- Aleatorizado
Tipos de investigación
Los estudios en animales y de laboratorio son cuando se examinan los efectos de un nutriente o alimento en animales o células en un tubo de ensayo. Este tipo de estudios se realizan con frecuencia en nutrición porque es difícil realizar estudios aleatorios en humanos de manera ética. Por ejemplo, los nutricionistas no pueden establecer un estudio y decirle a un grupo de personas que no ingieran proteínas porque si el estudio se prolongó durante demasiado tiempo, esos participantes morirían o sufrirían graves consecuencias para la salud. Entonces, lo mejor que puede hacer es hacer el estudio en animales y esperar que los resultados se traduzcan de manera similar a los humanos.
Los estudios de casos y controles toman a un grupo de personas que tienen una condición o resultado específico, como diabetes o pérdida de peso exitosa. Luego, los estudios comparan ese grupo con un grupo que no tiene esa condición o resultado. Los investigadores hacen preguntas sobre el comportamiento de los miembros del grupo. Por ejemplo, los nutricionistas pueden preguntar cuántas porciones de frutas y verduras comieron al día los miembros de cada grupo. Este tipo de estudio es útil porque en realidad estamos usando personas. Sin embargo, una deficiencia es que confiamos en que las personas recuerden lo que han hecho en el pasado y lo informen con precisión.
Los estudios de cohortes reúnen a un gran grupo de personas y los siguen durante un período de tiempo prolongado. ¡Esto puede ser incluso por 20 años o más! A lo largo del curso del estudio, se recopilarán datos sobre los participantes. Por ejemplo, los participantes pueden necesitar llevar un diario de alimentos detallando lo que han comido cada día. Al final del estudio (y a menudo durante ciertos puntos de control a lo largo del estudio) cada participante será evaluado para una variedad de condiciones de salud. Los alimentos ingeridos se pueden comparar con las condiciones de salud que tienen los participantes. Este tipo de estudio es mejor que el de casos y controles porque los investigadores no dependen de los participantes para recordar eventos pasados. Sin embargo, estos estudios son limitados porque todavía no hay aleatorización.
Los ensayos aleatorizados son ideales en muchos sentidos porque los investigadores pueden controlar muchos aspectos del estudio. Sin embargo, los investigadores deben tener cuidado con los problemas éticos con este tipo de estudio. Por ejemplo, si la investigación ha comenzado a mostrar que un tratamiento puede ser perjudicial para los participantes, entonces ese tratamiento debe interrumpirse. Estos estudios son aleatorios porque los grupos se dividen al azar y reciben diferentes tratamientos. Dado que estamos tratando con humanos en estos casos, a menudo puede ser difícil garantizar que los participantes sigan el tratamiento. Entonces, si bien este es un estudio ideal, todavía existen deficiencias asociadas con este tipo de investigación.
Al observar los resultados de la investigación nutricional, es importante determinar qué tipo de investigación se realizó. Si se trataba de una investigación en animales o de laboratorio, tome los resultados con un grano de sal. Los resultados pueden ser aplicables a humanos, pero no lo sabemos con certeza.
Al observar los resultados de casos y controles, examine qué preguntas hicieron los investigadores y hasta qué punto se esperaba que los participantes recordaran los eventos y lo que comieron en el pasado.
Al analizar los estudios de cohortes, es importante examinar cuántos controles tuvieron en cuenta los investigadores. Por ejemplo, si la investigación concluye que “las personas que comieron más manzanas resultaron en una mejor salud mental”, es posible que desee examinar si los investigadores tuvieron en cuenta las diferencias en el ejercicio, otros alimentos, antecedentes de salud mental, etc. Quizás las personas que hacen ejercicio simplemente tienden comer más manzanas que los que no hacen ejercicio, por lo que tal vez el ejercicio esté afectando la salud mental más que las manzanas.
Al mirar los estudios aleatorizados, debe examinar si los tratamientos hubieran sido fáciles o difíciles de seguir. ¿Qué probabilidad hay de que los participantes siguieran realmente el tratamiento prescrito?
Resumen de la lección
Un buen consejo nutricional se basará en una buena investigación nutricional. Podemos decir que la investigación nutricional es buena cuando sigue el método científico . Es importante examinar el tipo de experimento, que puede ser una investigación primaria o secundaria . La investigación primaria incluye estudios de laboratorio / animales , de casos y controles , de cohortes y aleatorizados . Cada tipo de investigación tiene limitaciones específicas que deben tenerse en cuenta.
Articulos relacionados
- ¿Cuáles son los Tipos de Vacunas?
- 6 Ejemplos de Marco Teórico en Diferentes Ámbitos de Investigación
- ¿Puedo Trabajar en EE. UU. si estoy estudiando?
- ¿Qué es el Diseño de Bioprocesos?
- ¿Qué es el Proceso Adiabático Reversible?
- ¿Qué es un Proceso Isotérmico Reversible?
- ¿Qué es un Proceso de Condensación?
- ¿Qué es un Proceso de Vaporización?
- ¿Qué papel juega el ciclo del nitrógeno en la nutrición de las plantas?
- ¿Cuáles son los Tipos de Tejidos?

Tipos de investigaciones sobre nutrición: comprensión de los estudios científicos
Equipo de I+D de ETprotein Perspectivas del consumidor y tendencias del mercado
Índice del contenido
Tipos de investigaciones sobre nutrición: exploración de la ciencia detrás de los estudios dietéticos, estudios observacionales en nutrición, estudios experimentales en nutrición, metanálisis y revisiones sistemáticas, investigación cualitativa en nutrición, estudios de casos y evidencia anecdótica, ejemplos y estudios de casos en investigación en nutrición, interpretación de la investigación nutricional, conclusión: conclusiones clave en la investigación sobre nutrición, mejore su nutrición con los productos proteicos de alta calidad de etprotein.
La investigación en nutrición es un campo vasto y complejo que abarca varios tipos de estudios científicos, cada uno con sus propias fortalezas y limitaciones. Comprender estas diferentes metodologías de investigación es crucial para interpretar los resultados de los estudios y tomar decisiones informadas sobre la dieta y la salud. Este artículo profundiza en los principales tipos de investigación en nutrición, brindando información sobre cómo cada uno contribuye a nuestra comprensión de la intrincada relación entre alimentación y salud.
Los estudios observacionales son una piedra angular de la investigación en nutrición. Implican monitorear a un grupo de individuos a lo largo del tiempo para recopilar datos sobre sus hábitos dietéticos y resultados de salud. Estos estudios se pueden clasificar además en tres tipos principales:
- Estudios transversales: Estos estudios examinan datos en un único momento, proporcionando una instantánea de los patrones dietéticos y de salud de la población.
- Estudios de casos y controles: Estos estudios comparan a individuos con una condición específica (casos) con aquellos sin la condición (controles) para identificar posibles factores dietéticos que pueden influir en el riesgo de desarrollar la condición.
- Escuadrón de estudio: En estos estudios, los investigadores siguen a un grupo de personas a lo largo del tiempo para observar cómo sus elecciones dietéticas afectan sus resultados de salud.
Si bien los estudios observacionales pueden revelar asociaciones entre la dieta y la salud, no pueden establecer la causalidad debido a posibles factores de confusión y sesgos.
Los estudios experimentales, también conocidos como estudios de intervención, están diseñados para probar los efectos de una intervención dietética específica en los resultados de salud. Los dos tipos principales de estudios experimentales son:
- Ensayos controlados aleatorios (ECA): Los ECA se consideran el estándar de oro en la investigación sobre nutrición. Los participantes son asignados aleatoriamente al grupo de intervención, que recibe el tratamiento dietético, o al grupo de control, que no lo recibe. Esta aleatorización ayuda a minimizar sesgos y factores de confusión.
- Ensayos clínicos controlados (CCT): Los ECC son similares a los ECA, pero es posible que no impliquen aleatorización. Si bien pueden proporcionar información valiosa, la falta de aleatorización puede introducir sesgos.
Los estudios experimentales pueden establecer la causalidad, pero a menudo son costosos, requieren mucho tiempo y no siempre son factibles o éticos.
Los metanálisis y las revisiones sistemáticas son métodos de investigación que recopilan y analizan datos de múltiples estudios para extraer conclusiones más sólidas. Una revisión sistemática es un estudio exhaustivo de la literatura sobre un tema en particular, mientras que un metanálisis utiliza técnicas estadísticas para combinar los resultados de diferentes estudios. Estos métodos ayudan a superar las limitaciones de los estudios individuales y brindan un mayor nivel de evidencia.
La investigación cualitativa explora los comportamientos, percepciones y experiencias de las personas con la alimentación y la nutrición. Métodos como entrevistas, grupos focales y estudios etnográficos proporcionan conocimientos profundos que los métodos cuantitativos tal vez no capturen. Aunque la investigación cualitativa no produce datos generalizables, es invaluable para comprender el contexto y las complejidades de los comportamientos alimentarios.
Los estudios de casos implican exámenes detallados de experiencias individuales o grupales con intervenciones dietéticas. Si bien pueden ofrecer historias e hipótesis convincentes para futuras investigaciones, carecen del rigor y la generalización de estudios más amplios. La evidencia anecdótica, como los testimonios personales, es aún menos confiable debido a la ausencia de una recopilación sistemática de datos y a posibles sesgos.
Un ejemplo notable de estudio de cohorte a gran escala es el Estudio de salud de las enfermeras, que ha proporcionado información valiosa sobre los efectos a largo plazo de la dieta en las enfermedades crónicas. Por otro lado, el estudio PREDIMED, un ECA de referencia, demostró los beneficios cardiovasculares de una dieta mediterránea suplementada con frutos secos o aceite de oliva.
Los metanálisis también han desempeñado un papel importante en la ciencia de la nutrición. Por ejemplo, un metanálisis de estudios de cohortes prospectivos encontró una asociación significativa entre un mayor consumo de carne roja y procesada y un mayor riesgo de mortalidad por todas las causas y enfermedades cardiovasculares.
Al evaluar la investigación sobre nutrición, es esencial considerar el diseño del estudio, el tamaño de la muestra, la duración y los posibles conflictos de intereses. También es crucial observar la totalidad de la evidencia en lugar de confiar en un solo estudio. La ciencia de la nutrición evoluciona continuamente y las recomendaciones pueden cambiar a medida que surgen nuevas pruebas.
La investigación sobre nutrición es diversa y cada tipo de estudio aporta información valiosa a nuestra comprensión de la dieta y la salud. Los estudios observacionales pueden identificar patrones y asociaciones, mientras que los estudios experimentales pueden probar la causalidad. Los metanálisis y las revisiones sistemáticas proporcionan un mayor nivel de evidencia al sintetizar datos de múltiples estudios. La investigación cualitativa y los estudios de casos ofrecen contexto y profundidad a los datos cuantitativos. Para tomar decisiones informadas sobre nutrición, es crucial considerar las fortalezas y limitaciones de cada tipo de investigación y observar el conjunto general de evidencia.
Si buscas incorporar proteínas de alta calidad a tu dieta, ETprotein ofrece una gama de proteínas veganas orgánicas a granel que satisfacen diversas necesidades. Sus productos, que incluyen proteína de arroz, proteína de guisante y proteínas a base de semillas, no contienen OGM, no contienen alérgenos y se caracterizan por un sabor neutro. Los suplementos de L-(+)-ergotioneína (EGT) de ETprotein están disponibles en diferentes grados, adecuados para aplicaciones nutracéuticas, farmacéuticas y cosmecéuticas. Mejora tu nutrición con las soluciones proteicas puras y confiables de ETprotein.
Acerca de la proteína ET:
ETprotein, un reputado fabricante y proveedor chino de proteínas y L-(+)-ergotioneína (EGT), es reconocido por producir, almacenar, exportar y entregar proteínas veganas orgánicas a granel y L-(+)-ergotioneína de la más alta calidad. Incluyen proteína de arroz orgánica, proteína clara de arroz, proteína de guisante, proteína de guisante clara, proteína de semilla de sandía, proteína de semilla de calabaza, proteína de semilla de girasol, proteína de frijol mungo, proteína de maní y L-(+)-ergotioneína EGT de grado farmacéutico, L- (+)-Ergotioneína EGT de grado alimentario, L-(+)-Ergotioneína EGT de grado cosmético, L-(+)-Ergotioneína EGT de grado de referencia y L-(+)-Ergotioneína EGT estándar. Sus ofertas, caracterizadas por un sabor neutro, atributos sin OGM y sin alérgenos, con una pureza de L-(+)-ergotioneína superior al 98%, 99%, atienden a una amplia gama de industrias. Prestan servicios a distribuidores, comerciantes y fabricantes de productos terminados nutracéuticos, farmacéuticos, cosmecéuticos, veterinarios y de alimentos y bebidas en Europa, EE. UU., Canadá, Australia, Tailandia, Japón, Corea, Brasil y Chile, entre otros.
La especialización de ETprotein incluye la exportación y entrega de proteína en polvo hecha a medida y suplementos nutricionales terminados. Su amplia gama de productos cubre sectores como alimentos y bebidas, nutrición deportiva, control de peso, suplementos dietéticos, productos de salud y bienestar y fórmulas infantiles, lo que garantiza soluciones integrales para satisfacer todas sus necesidades de proteínas.
Como empresa confiable para las principales marcas mundiales de alimentos y bebidas y compañías Fortune 500, ETprotein refuerza la reputación de China en el ámbito global. Para obtener más información o probar sus productos, comuníquese con ellos y envíe un correo electrónico a sales(at)ETprotein.com hoy.
Equipo de I+D de ETprotein
Artículos relacionados.

Perspectivas del consumidor y tendencias del mercado
Formas en que las tecnologías de vanguardia están avanzando en las pruebas de seguridad alimentaria

Distribución mayorista: un eslabón crítico en la cadena de suministro

Técnicas utilizadas por la industria alimentaria para realizar pruebas de alimentos
Ricepro™: proteína de arroz orgánica.

Riptdies™: proteína de arroz transparente, péptido de arroz hidrolizado, sabor neutro

Venta al por mayor de productos proteicos Obtenga precio y muestra hoy [email protected]
Peapro™ - proteína de guisante orgánica.

Peatides™: proteína de guisante transparente, péptido de guisante hidrolizado, sabor neutro

Peatides™ - Péptido de guisante hidrolizado de proteína de guisante transparente, sabor neutro
Proteína de guisante texturizada texpea™.


Proteína de semilla de calabaza orgánica

Proteína de semilla de calabaza orgánica PumpteinX™
Sunpro™-proteína de semilla de girasol.

Munptein™-Proteína de frijol mungo

¡RECIÉN LANZADO! ¡NUEVA REVOLUCIÓN!
¿Cuál es el ÚNICO ingrediente antienvejecimiento que puede penetrar tanto en las mitocondrias como en el núcleo celular? Quién es ¿Conoce al nuevo rey de los antioxidantes?
Es ErgoElite™ – ¡Ergotioneína!
Ningún otro ingrediente puede hacerlo. Es una revolución revolucionaria.
Para el golpe de gracia: ¡la ergotioneína supera al glutatión 6 veces, a la astaxantina 46 veces y debilita la vitamina E 3017 veces! (Comprueba la foto) Famoso por retrasar el envejecimiento, eliminar la fatiga y mejorar la mente, el corazón y el estado de ánimo. Perfecto para la aplicación de suplementos y cuidado de la piel.
¿Preocupado por el precio? ¡Nuestra tecnología de talentos lo redujo en un 90%! ¡Es el ingrediente imprescindible para 2025!
¿Listo para potenciar su empresa con ErgoElite™?

- Skip to main content
- Skip to primary sidebar
- Skip to footer
- QuestionPro

- Soluciones Soluciones Muestra Online Comunidades Online Encuestas Offline Dashboards Journey mapping Repositorio de Insights Quizzes y sondeos Licencia Académica Herramientas Net Promoter Score AskWhy Análisis Conjoint MaxDiff Closed-Loop Van Westendorp
- Recursos Blog eBooks Webinarios Plantillas para encuestas Estudios de caso Centro de ayuda
- Características
Inicio Investigación de mercado
Diferencia entre estudio experimental y observacional

Entender la diferencia entre estudio experimental y observacional es crucial para interpretar los hallazgos y extraer conclusiones válidas. Ambos métodos se utilizan ampliamente en diversos campos, incluidos la medicina, las ciencias sociales y los estudios ambientales.
Conozcamos más de estas diferencias para poder realizar el estudio que más convenga a nuestros objetivos.
¿Qué es un estudio experimental?
Un estudio experimental es un diseño de investigación en el que el investigador manipula activamente una o más variables para observar su efecto en otra variable. Este tipo de estudio suele realizarse en un entorno controlado, lo que permite a los investigadores establecer relaciones de causa y efecto.
Características de los estudios experimentales:
- Manipulación : Los investigadores manipulan las variables independientes.
- Control : Otras variables se mantienen constantes para aislar el efecto de la variable independiente.
- Aleatorización : Los sujetos se asignan aleatoriamente a diferentes grupos para minimizar sesgos.
- Replicación : El estudio puede replicarse para verificar los resultados.
Tipos de estudios experimentales:
- Experimentos de laboratorio : Realizados en un entorno controlado donde se pueden controlar con precisión las variables.
- Investigación de campo : Se llevan a cabo en un entorno natural pero aún implican la manipulación y el control de variables.
- Ensayos clínicos : Utilizados en la investigación médica y en la industria de la salud para probar la eficacia de nuevos tratamientos o medicamentos.
Ejemplo de un estudio experimental:
Imagina un estudio para probar la efectividad de un nuevo medicamento para reducir la presión arterial. Los investigadores:
- Asignan aleatoriamente a los participantes en dos grupos: uno recibe el medicamento y el otro un placebo.
- Aseguran que los participantes no sepan a qué grupo pertenecen (procedimiento doble ciego).
- Miden la presión arterial antes y después de la intervención.
- Comparan los cambios en la presión arterial entre los dos grupos para determinar la efectividad del medicamento.
¿Qué es un estudio observacional?
Un estudio observacional es un diseño de investigación en el que el investigador observa a los sujetos y mide las variables sin intervenir ni manipular el entorno de estudio. Este tipo de estudio se utiliza a menudo cuando la manipulación de variables es impráctica o poco ética.
Características clave de los estudios observacionales:
- Sin manipulación : Los investigadores no manipulan la variable independiente.
- Entorno natural : Las observaciones se realizan en un entorno natural.
- Limitaciones en la causalidad : Es difícil establecer relaciones de causa y efecto debido a la falta de control sobre las variables.
- Descriptivo : A menudo se utiliza para describir características o resultados.
Tipos de estudios observacionales:
- Estudios de cohorte : Siguen a un grupo de personas a lo largo del tiempo para observar el desarrollo de resultados.
- Estudios de casos y controles : Comparan a individuos con un resultado específico (casos) con aquellos sin el resultado (controles) para identificar factores que podrían contribuir al resultado.
- Estudios transversales : Recogen datos de una población en un solo momento para analizar la prevalencia de un resultado o característica.
Ejemplo de un estudio observacional:
Considera un estudio que examine la relación entre el tabaquismo y el cáncer de pulmón. Los investigadores:
- Identifican una cohorte de fumadores y no fumadores.
- Siguen a ambos grupos a lo largo del tiempo para registrar la incidencia de cáncer de pulmón.
- Analizan los datos para observar diferencias en las tasas de cáncer entre fumadores y no fumadores.
Diferencias entre estudios experimentales y observacionales
En el campo de la investigación, es fundamental entender las diferencias entre los estudios experimentales y observacionales, ya que cada enfoque tiene su propio propósito, metodología y aplicaciones:
¿Cuándo usar estudios experimentales?
Los investigadores se basaron en el análisis estadístico para interpretar los resultados de los ensayos controlados aleatorizados, partiendo de las bases establecidas por investigaciones anteriores.
Utilizar estudios experimentales cuando:
- La causalidad es importante : Si es crucial determinar una relación de causa y efecto, los estudios experimentales son el camino a seguir.
- Las variables pueden controlarse : Cuando puedes manipular y controlar las variables en un laboratorio o entorno controlado, los estudios experimentales son adecuados.
- La aleatorización es posible : Cuando la asignación aleatoria de sujetos es factible y ética, los diseños experimentales son apropiados.
¿Cuándo usar estudios observacionales?
- Existen preocupaciones éticas : Si la manipulación de variables es poco ética, como exponer a las personas a sustancias nocivas, los estudios observacionales son necesarios.
- Existen restricciones prácticas : Cuando los estudios experimentales son imprácticos debido al costo o la logística, los estudios observacionales pueden ser una alternativa viable.
- Se requieren entornos naturales : Si estudiar fenómenos en su entorno natural es esencial, los estudios observacionales son la opción adecuada.
Fortalezas y limitaciones
Al analizar las metodologías de investigación , tanto los estudios experimentales como los observacionales presentan fortalezas y limitaciones que los hacen adecuados para diferentes contextos:
Estudios experimentales
- Establecen causalidad : Los estudios experimentales pueden establecer relaciones causales entre variables mediante el control y la aleatorización.
- Control sobre variables confusas : El entorno controlado permite a los investigadores minimizar la influencia de variables externas que podrían sesgar los resultados.
- Repetibilidad : Los experimentos pueden repetirse a menudo para verificar los resultados y garantizar la consistencia.
- Preocupaciones éticas : Manipular variables puede ser poco ético en ciertas situaciones, como exponer a las personas a condiciones dañinas.
- Entorno artificial : El entorno controlado puede no reflejar las condiciones del mundo real, lo que puede afectar la generalización de los resultados.
- Costo y complejidad : Los estudios experimentales pueden ser costosos y logísticamente complejos, especialmente con grandes tamaños de muestra.
Estudios observacionales
- Información del mundo real : Los estudios observacionales proporcionan valiosos conocimientos sobre cómo interactúan las variables en entornos naturales.
- Ético y práctico : Estos estudios evitan preocupaciones éticas asociadas con la manipulación y pueden ser más prácticos en términos de costo y tiempo.
- Aplicaciones diversas : Los estudios observacionales pueden utilizarse en varios campos y situaciones donde los experimentos no son factibles.
- Falta de causalidad : Es más difícil establecer una causalidad sin manipulación, y los resultados se limitan a identificar correlaciones.
- Potencial de confusión : Las variables externas no controladas pueden influir en los resultados, lo que lleva a conclusiones sesgadas.
- Sesgo del observador : Los investigadores pueden influir involuntariamente en los resultados a través de sus expectativas o interpretaciones de los datos.
Diferencia entre estudio experimental y observacional: Ejemplos de usos en varios campos
- Estudio experimental : Ensayos clínicos que prueban la efectividad de un nuevo medicamento frente a un placebo para determinar su impacto en la recuperación de los pacientes.
- Estudio observacional : Estudiar los hábitos alimentarios de diferentes poblaciones para identificar posibles vínculos entre la nutrición y la prevalencia de enfermedades.
- Estudio experimental : Realizar un experimento de laboratorio para probar el efecto de la privación del sueño en el rendimiento cognitivo controlando las horas de sueño y midiendo los puntajes de las pruebas.
- Estudio observacional : Observar interacciones sociales en un entorno público para explorar patrones naturales de comunicación sin intervención.
- Estudio experimental : Probar el impacto de un contaminante específico en el crecimiento de las plantas en un entorno controlado de invernadero.
- Estudio observacional : Monitorear poblaciones de vida silvestre en un hábitat natural para evaluar los efectos del cambio climático en la distribución de especies.
Cómo QuestionPro Research puede ayudar en estudios experimentales y observacionales
Elegir entre estudios experimentales y observacionales es una decisión crítica que puede influir significativamente en los resultados e interpretaciones de un estudio. QuestionPro Research ofrece herramientas y características poderosas que pueden mejorar ambos tipos de estudios, brindando a los investigadores la flexibilidad y capacidad para recopilar, analizar e interpretar datos de manera efectiva.
Haz estudios experimentales con QuestionPro
Los estudios experimentales requieren un alto grado de control sobre las variables, aleatorización y, a menudo, ensayos repetidos para establecer relaciones causales. QuestionPro sobresale en facilitar estos requisitos a través de varias características clave:
- Diseño y distribución de encuestas : Con QuestionPro , los investigadores pueden diseñar encuestas intrincadas adaptadas a sus necesidades experimentales. La plataforma admite la asignación aleatoria de participantes a diferentes grupos, lo que garantiza una distribución imparcial y mejora la validez del estudio.
- Recopilación y gestión de datos : Las herramientas de recopilación y gestión de datos en tiempo real permiten a los investigadores monitorear las respuestas a medida que llegan. Esto es crucial para los estudios experimentales donde el momento y la secuencia de la recopilación de datos pueden impactar los resultados.
- Analítica avanzada : QuestionPro ofrece herramientas analíticas robustas que pueden manejar conjuntos de datos complejos, lo que permite a los investigadores realizar análisis estadísticos en profundidad para determinar los efectos de las intervenciones experimentales.
Apóyate en QuestionPro para tus estudios observacionales
Los estudios observacionales implican la recopilación de datos sin manipular variables, centrándose en entornos naturales y escenarios del mundo real. Las capacidades de QuestionPro también son adecuadas para estos estudios:
- Encuestas personalizables : Los investigadores pueden crear encuestas detalladas para capturar una amplia gama de datos observacionales. Los plantillas personalizables y tipos de preguntas de QuestionPro permiten flexibilidad en la captura de información matizada.
- Recopilación de datos móviles : Para la investigación de campo, la aplicación móvil de QuestionPro permite la recopilación de datos sobre la marcha, lo que facilita la realización de estudios en entornos diversos sin conexión a internet.
- Seguimiento de datos longitudinales : Los estudios observacionales a menudo requieren la recopilación de datos durante períodos prolongados. La plataforma de QuestionPro admite estudios longitudinales, lo que permite a los investigadores rastrear cambios y tendencias.
Los estudios experimentales y observacionales son herramientas esenciales en el conjunto de habilidades del investigador. Cada uno cumple un propósito único y ofrece ventajas y limitaciones distintas. Al comprender sus diferencias, los investigadores pueden elegir el diseño de estudio más adecuado para sus objetivos específicos, asegurando que sus hallazgos sean válidos y aplicables a situaciones del mundo real.
Ya sea estableciendo causalidad a través de estudios experimentales o explorando correlaciones con diseños de investigación observacionales, los conocimientos obtenidos de estas metodologías continúan dando forma a nuestra comprensión del mundo que nos rodea.
Tanto en la realización de estudios experimentales como observacionales, QuestionPro Research proporciona un conjunto completo de herramientas que mejoran la eficiencia, precisión y profundidad de la investigación. Al aprovechar sus características avanzadas, los investigadores pueden garantizar que sus estudios estén bien diseñados, sus datos sean analizados de manera sólida y sus conclusiones sean fiables e impactantes.
MAS COMO ESTO

Dic 18, 2024

50 ejemplos de preguntas para amigos
Dic 17, 2024

Entrevistas de permanencia: Qué son y cómo llevarlas a cabo
Dic 16, 2024

Ponderación de resultados: Qué es, importancia y cómo funciona
Dic 13, 2024
Otras categorías
- Beneficios para empleados
- Capacitación
- Compromiso con el cliente
- Compromiso de los empleados
- Comunidades
- Comunidades en línea
- Conocimiento de la marca
- Entrenamiento
- Estrategia de marketing
- Estudios de casos
- Experiencia del Cliente
- Fuerza de Trabajo
- Funciones mejoradas
- Herramientas y aplicaciones de investigación
- InsightsHub
- Interceptar
- Investigación académica
- Investigación de Consumidores
- Investigación de mercado
- Lealtad del cliente
- Mejores Practicas
- Mercadotecnia
- Productos de QuestionPro
- Productos QuestionPro
- Retención de empleados
- Satisfacción al cliente
- Sin categorizar
- Software para Encuestas
- Startup @es
- Toma de decisiones
Servicios Personalizados
Indicadores, links relacionados.

Nutrición Hospitalaria
Versión on-line issn 1699-5198 versión impresa issn 0212-1611, nutr. hosp. vol.39 spe 1 madrid mar. 2022 epub 09-mayo-2022, https://dx.doi.org/10.20960/nh.04068 .
TRABAJOS ORIGINALES
Investigación en nutrición clínica y generación de nuevas evidencias: el programa NutriCOVer
Investigation in clinical nutrition and generation of new evidence: the NutriCOVer program
1 Servicio de Endocrinología y Nutrición. Hospital Regional Universitario de Málaga. Instituto de Investigación Biomédica de Málaga. Departamento de Medicina y Dermatología. Universidad de Málaga. Málaga
2 Laboratorio de Fisiología Gastrointestinal. Hospital de Mataró. Universidad Autónoma de Barcelona. Mataró, Barcelona
3 Servicio de Endocrinología y Nutrición. Hospital Universitario Príncipe de Asturias. Universidad de Alcalá. Alcalá de Henares, Madrid
4 Sección de Nutrición. Hospital General Universitario Gregorio Marañón. Universidad Complutense. Madrid
5 Servicio de Endocrinología y Nutrición. Hospital Universitario Virgen de la Victoria. Málaga
6 Servicio de Endocrinología y Nutrición. Hospital Universitario Germans Trias i Pujol. Badalona, Barcelona
NutriCOVer es un programa de investigación impulsado por Nutricia a nivel global para apoyar iniciativas de investigación clínica en 16 países de todo el mundo. El programa tiene como objetivo adaptar el cuidado nutricional a las necesidades de los pacientes con COVID-19 dados de alta de la unidad de cuidados intensivos.
En España se están desarrollando tres proyectos de investigación, siendo un país de referencia dentro del programa NutriCOVer. Estos estudios analizan la evolución de los pacientes tras una COVID-19 grave desde el punto de vista nutricional, evaluando aspectos relevantes como la prevalencia y evolución de la desnutrición y la sarcopenia (estudio NUTRICOVID), la prevalencia y el impacto de la disfagia (estudio COVID-19-DN-OD) y los cambios de la composición corporal medida por ecografía nutricional y bioimpedanciometría (estudio NUTRIECOMUSCLE).
En este artículo, los investigadores que lideran estos tres proyectos discuten todos los pasos que han seguido para el desarrollo de los estudios en el contexto de una pandemia mundial: desde la idea inicial, el diseño y el reclutamiento de pacientes hasta los problemas de ejecución que se han encontrado en el día a día o la política de publicación de los resultados. Además, ofrecen algunas impresiones sobre los resultados iniciales y las implicaciones que pueden tener estos estudios para cambiar la práctica clínica habitual.
Palabras clave: Investigación biomédica; Investigación en medicina traslacional; Planes y programas de investigación en salud; Foros de discusión; Promoción de la investigación; Estado nutricional
NutriCOVer is a global research program sponsored by Nutricia to support initiatives in clinical investigation in 16 countries worldwide. The program's objective is to adapt nutritional care to the needs of patients with COVID-19 who have been discharged from the intensive care unit.
In Spain — a reference country for the NutriCOVer program — three research projects are being carried out. These studies analyze the clinical course of COVID-19 patients from a nutritional point of view, evaluating relevant aspects such as the prevalence and evolution of malnutrition and sarcopenia (the NUTRICOVID study), the prevalence and impact of dysphagia (the COVID-19-DN-OD study), or changes in corporal composition measured through nutritional ultrasound and bioimpedance analysis (the NUTRIECOMUSCLE study).
In this article, the principal investigators of the three projects discuss the steps taken to develop these studies in the context of a worldwide pandemic: from initial concept, study design, and patient recruitment to problems in the execution of the project in day-to-day practice and publication policies. Also, they offer some insights on the initial results and the implications which these studies may have for current clinical practice.
Keywords: Biomedical research; Translational medical research; Health research plans and programs; Discussion forums; Research promotion; Nutritional status
INTRODUCCIÓN
Los pacientes con COVID-19 presentan una elevada tasa de hospitalización y muchos requieren un ingreso en la unidad de cuidados intensivos (UCI). Tras el alta de cuidados intensivos, una alta proporción de pacientes pueden estar desnutridos o en riesgo de desnutrición. Sin embargo, los datos sobre el estado nutricional y las necesidades de los pacientes con COVID-19 dados de alta de la UCI son limitados.
El programa NutriCOVer es un programa impulsado por Nutricia para apoyar iniciativas de investigación clínica en 16 países de todo el mundo. Tiene como objetivo adaptar el cuidado nutricional a las necesidades de los pacientes con COVID-19 dados de alta de la UCI. España es un país de referencia dentro de este programa pues aquí se desarrollan tres de los principales proyectos del mismo. Los objetivos principales de estos tres estudios se resumen en la tabla I .
Tabla I. Proyectos de investigación en España del programa NutriCOVer
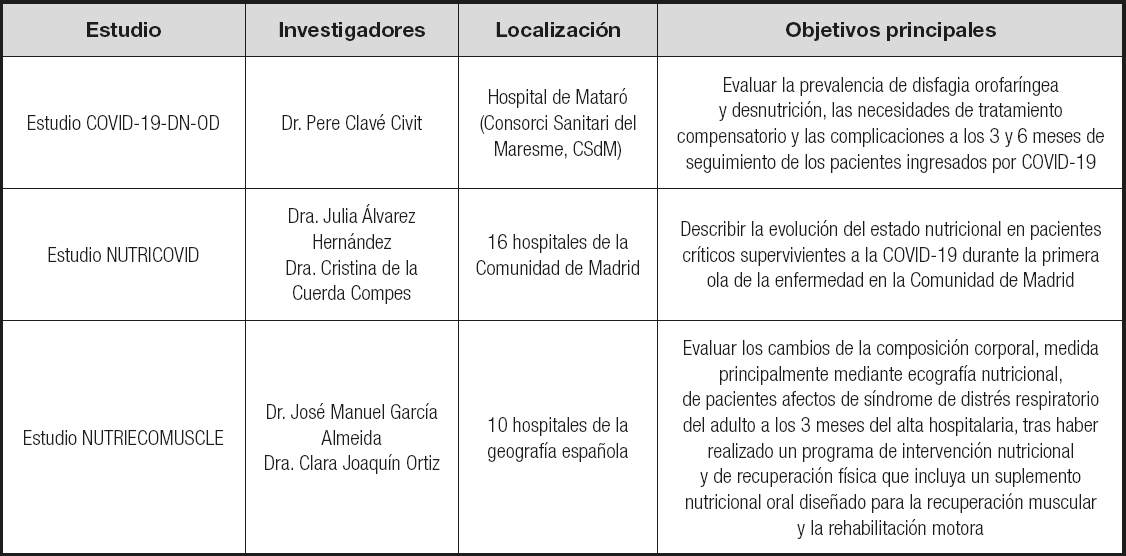
En este artículo se resume una tertulia entre los investigadores principales de estos tres estudios. Tras una breve presentación sobre la investigación en nutrición clínica, cinco de los investigadores que lideran los proyectos discuten todos los pasos que han seguido para el desarrollo de los mismos, desde la idea inicial de investigación hasta su publicación. Además, se comentan los retos y dificultades para su desarrollo en el contexto de una pandemia mundial que ha desbordado los servicios sanitarios. Asimismo, se presentan y discuten algunos resultados iniciales de los tres estudios.
Este trabajo ilustra la importancia de la investigación en nutrición clínica y cómo estudios como los que se desarrollan dentro del programa NutriCOVer pueden generar evidencia, tener un impacto relevante en la práctica asistencial y mejorar calidad de vida de los pacientes.
INTRODUCCIÓN A LA INVESTIGACIÓN EN NUTRICIÓN CLÍNICA. PROYECTO NutriCOVer
La prevalencia de la desnutrición relacionada con la enfermedad (DRE) es muy elevada en el ámbito hospitalario y tiene amplias repercusiones clínicas en términos de morbimortalidad, calidad de vida y costes sanitarios. Por ello, la investigación en nutrición clínica es esencial para mejorar los resultados de salud con el objetivo de disminuir las complicaciones y mejorar la calidad de vida de los pacientes y, también, para disminuir los costes o utilizar mejor los recursos. En los últimos años se han producido innovaciones en numerosos áreas del conocimiento que afectan a la nutrición clínica: bioquímica clásica, microbiota, epigenética, genómica, proteómica, metabolómica, cultivos celulares, modelos animales, etc. Además, se han generado importantes avances en la medida de la composición corporal, en la valoración de la funcionalidad y en la terapia médica nutricional (nuevas formulaciones y mejoras e innovación en los sistemas de administración). La prevalencia de la desnutrición entre los pacientes hospitalizados por SARS-CoV-2 (COVID-19) es muy elevada ( 1 ).
La investigación en nutrición debe ser, en la medida de lo posible, una investigación traslacional. Es la manera más rápida de conseguir que los nuevos conocimientos científicos sean transferidos no solamente a la investigación clínica sino también a la práctica asistencial. La investigación traslacional es «la investigación multidisciplinar sobre problemas clínicos que traslada el conocimiento adquirido en el laboratorio a los métodos de prevención, diagnóstico o terapia en pacientes y que utiliza datos de pacientes e información obtenida de la práctica clínica».
La investigación traslacional comprende, por tanto, desde estudios en modelos electrónicos, celulares y animales (siempre que se utilicen genes, células o datos obtenidos de pacientes en la práctica clínica), incluyendo todas las fases de los ensayos clínicos, estudios observacionales y estudios poscomercialización hasta la toma de decisiones terapéuticas en la práctica clínica diaria.
En la investigación en general, y en nutrición en particular, los clínicos juegan un papel clave. La práctica clínica puede dar como resultado una información muy valiosa y, si el clínico es capaz de integrar asistencia/práctica clínica e investigación, se convierte en el protagonista del cambio.
Sin embargo, la investigación y las innovaciones no surgen por generación espontánea. Hacen falta una serie de condicionantes previos. Por encima de todo, hace falta cultivar una «cultura de investigación». Las unidades de nutrición y, en general, todos los servicios clínicos deben integrar en su actividad la investigación clínica y traslacional. Los centros donde se conjugan asistencia, docencia e investigación se caracterizan por tener la mayor calidad asistencial. Cuando las unidades realizan investigación, independientemente del tipo y extensión, se alcanzan mayores cotas de calidad en la atención sanitaria que presta a sus usuarios ( 2 ). En general, para conseguir que la investigación produzca cambios en la práctica clínica, mejore los resultados de salud, se publique en revistas de alto impacto bibliométrico o se acompañe de patentes, los estudios suelen ser multicéntricos y, a ser posible, de intervención o que incluyan técnicas específicas o innovadoras.
Por otra parte, la COVID-19 ha supuesto un reto sin precedentes para el mundo y ha cambiado nuestras vidas en muy poco tiempo de forma radical. La pandemia ha tenido importantes repercusiones sanitarias y económicas y ha revolucionado la investigación con aspectos tanto positivos como negativos.
Dentro de los aspectos positivos, en un periodo cortísimo de tiempo se ha avanzado notablemente en la investigación, produciéndose avances que se han traducido en cambios en la práctica clínica a una velocidad nunca vista ( 3 , 4 ). A la par que se generaban nuevos conocimientos, se han comunicado los resultados de la investigación prácticamente en tiempo real, con amplia repercusión en los medios y en las redes sociales. En este sentido cabe destacar, entre los aspectos negativos, que en muchas ocasiones ha faltado reflexión y se han aplicado tratamientos sin una base suficientemente sólida ( 5 ).
En los pacientes con COVID-19, la nutrición clínica resulta ser una terapia de soporte esencial que, junto con corticoides, oxigenoterapia y anticoagulantes, ha salvado más vidas que muchos tratamientos ensayados. Además, al ser transversal, desempeña un papel esencial en todas las fases de la infección por COVID-19, no solo en la fase aguda, y tiene importantes repercusiones sanitarias, sociales y económicas.
Algunas características de estos tres estudios se resumen en la tabla I . A continuación, los principales investigadores de estos proyectos discuten el arranque y desarrollo de los estudios, y presentan algunos resultados preliminares.
¿Cómo surge la idea del proyecto?
Dra. Julia Álvarez Hernández
La Dra. Cristina de la Cuerda Compes y yo estamos aquí en nombre de todo un gran colectivo de investigadores involucrados en el estudio NUTRICOVID, con el auspicio de la Sociedad de Endocrinología, Nutrición y Diabetes de la Comunidad de Madrid (SENDIMAD).
Desde que comenzó la pandemia, los profesionales sanitarios dedicados a la nutrición clínica hemos estado muy sensibilizados con lo que implica la infección por SARS-CoV-2. Por razones personales o profesionales, en nuestra actividad asistencial clínica diaria somos testigos de la implicación de los aspectos nutricionales en la evolución de esta enfermedad.
En este contexto, el 5 de mayo, en una reunión con Nutricia para preparar el curso precongreso-SENPE 2021, nos informaron de la liberación de un presupuesto importante a nivel internacional para investigación sobre nutrición y COVID-19. En dos días se tenía que presentar el proyecto en los Países Bajos. La Dra. de la Cuerda Compes y yo estuvimos pensando en la falta de conocimiento sobre el estado nutricional de los pacientes y la Dra. de la Cuerda Compes propuso desarrollar la investigación bajo el paraguas de la SENDIMAD. Esta sociedad ya tiene un grupo de trabajo potente y la colaboración siempre es muy fluida. Por medios telemáticos, en medio de la enorme sobrecarga de trabajo de la primera ola en Madrid y en apenas 48 horas se fueron depurando posibles preguntas de investigación y se diseñó el proyecto que finalmente fue presentado con éxito en los Países Bajos con muy buenas críticas por su interés y rigurosidad.
Dr. Pere Clavé Civit
Nuestro estudio se planteó casi «por desesperación» en medio de una primera ola en la que la pandemia nos arrolló. Yo he sido durante diez años presidente de la European Society for Swallowing Disorders (ESSD) y, en una de mis últimas acciones, organizamos un webinario intentando ofrecer a los clínicos que manejan pacientes con disfagia diez puntos elementales para manejar bien a dichos pacientes y también proteger a los profesionales. La mayoría de nuestros procedimientos generan aerosoles y, por tanto, el riesgo de contagio es muy alto.
La COVID-19 se asocia a trastornos de la percepción a nivel del olfato y del gusto, y esto se puede asociar con trastornos de la deglución, los cuales a su vez se asocian con neumonías aspirativas y desnutrición. Así que comenzamos a pensar en la prevalencia y el impacto de la disfagia en los pacientes con COVID-19. La desesperación venía por ver que esto pasaba en el hospital. Lo que estábamos intentando conceptualizar estaba ocurriendo en nuestro centro.
Aquí quiero agradecer el papel de Nutricia por proporcionar certidumbre en un momento en que el que nadie tenía ninguna. Con la financiación necesaria, el estudio se diseñó y se puso en marcha muy rápidamente a pesar de las muchísimas dificultades y gracias al enorme esfuerzo del personal investigador. El reto era muy grande: cribar a todos los pacientes con COVID-19 que ingresaban en el centro, en un contexto de pandemia, sin vacunas y desbordados por las sobrecarga asistencial. Actualmente hemos cribado a más de 1500 pacientes y hemos aprendido mucho.
De esta situación se pueden sacar tres grandes mensajes. El primero es el valor y la importancia de estar preparados para hacer investigación clínica. Especialmente en un momento en el que hace falta recoger datos de forma sistemática para responder a preguntas y resolver problemas apremiantes de los pacientes. Por ello es esencial tener formación y experiencia en la investigación, al igual que en otros aspectos del manejo clínico de los pacientes. En segundo lugar, hay que reconocer que el impacto clínico que tiene esta enfermedad desde el punto de vista nutricional es muy grande. En tercer lugar, hay que recordar algo tan prevalente y tan olvidado como la disfagia. Si muchos clínicos no ven la desnutrición, la disfagia sería ya la «gran invisible».
Respecto al estudio NUTRIECOMUSCLE, ¿cómo surge la idea de un ensayo con ecografía nutricional cuando es una técnica que todavía está en desarrollo y en un contexto de tantas dificultades?
Dra. Clara Joaquín Ortiz
Nos dimos cuenta de que nuestros pacientes con COVID-19 perdían mucha masa muscular y mucho peso a expensas de esa masa muscular. Necesitábamos objetivar esos cambios y ver cómo evolucionaban. Entonces, desde el comité gestor del área de nutrición de la Sociedad Española de Endocrinología y Nutrición (SEEN), empezamos a trabajar en el tema y José Manuel García Almeida propuso la ecografía nutricional.
Dr. José Manuel García Almeida
Yo también estaba en la dinámica de la sobrecarga asistencial en medio de la pandemia, coordinando una planta de ocho médicos y dos enfermeras, cuando pensé en el posible papel de la ecografía en estos pacientes. Como siempre, la duda y la pregunta de investigación surge de la clínica y ello es muy motivador.
Yo tenía el antecedente de haber visto más de veinte pacientes que iban saliendo de la UCI con pérdida muscular y veía en la ecografía la foto de la afectación muscular y la grasa inflamada. Era algo que había investigar.
Teniendo estos antecedentes y en medio de la pandemia, ¿cuál era la pregunta de investigación que emanaba de la práctica clínica y que había que responder?
Era muy evidente que los pacientes se deterioraban rápidamente desde el punto de vista nutricional y funcional. La pérdida funcional se relaciona en gran medida con la disfagia. Además, había una situación neurológica sensorial con pérdida de la percepción del gusto y el olfato, y muchos pacientes sufrían estados confusionales de diverso grado, lo que acrecienta los trastornos de la deglución.
En este contexto, la primera pregunta que nos hicimos fue: ¿Cómo son de prevalentes los trastornos de la deglución y la desnutrición de nuestros pacientes? En segundo lugar: ¿Cómo impactan estos trastornos de la deglución en su pronóstico? En tercer lugar, dado que ya vimos que la primera ola nos atropellaba, nos preguntamos: ¿Es posible tratar y prevenir estos trastornos? ¿Cómo podemos hacerlo? Luego hemos ido añadiendo matices y otra preguntas, pero este era el marco global del estudio.
¿Cómo se planteó el seguimiento del estudio?
Decidimos hacer un seguimiento de seis meses teniendo en cuenta nuestra capacidad para llevar a cabo el estudio. Recogimos datos de antes del ingreso, del ingreso, al alta, y a los tres y seis meses del alta. Hasta el momento hemos recogido datos de unos 1500 pacientes y tenemos analizados casi una tercera parte.
Dra. Cristina de la Cuerda Compes
Nosotros, en medio de una situación que también nos desbordaba, pensamos que era necesario hacer una recogida de datos principalmente de forma prospectiva, aunque el estudio se planteó de forma ambispectiva, es decir, incluyendo una parte retrospectiva que se hacía telefónicamente y recogiendo datos de la historia clínica de forma sencilla. Desde el principio nos planteamos que la evolución se pudiera hacer de forma telemática y con un seguimiento de un año, seleccionando pruebas de cribado sencillas de la desnutrición y la sarcopenia junto con pruebas de evaluación de la capacidad funcional del paciente y la calidad de vida. Este diseño sencillo fue un acierto porque nos ha permitido seguir a los pacientes sin tener pérdidas y reclutar el número de pacientes esperado.
En el caso del estudio NUTRIECOMUSCLE, ¿cómo se planteó el diseñó de un estudio tan complejo que no se puede hacer de forma telemática?
La ecografía nutricional es una técnica emergente y por ello, en primer lugar, necesitábamos formar a los investigadores en la técnica, para hacerla todos de manera homogénea. Desde Nutricia se aportaron los ecógrafos a los centros participantes.
Efectivamente, la ecografía depende mucho del explorador y era fundamental uniformar las medidas. Por ello era tan importante la formación. Desde la SEEN se facilita un curso acreditado en ecografía nutricional. Es interesante que ya exista capacitación para esta técnica emergente. La formación va tan rápida como la pandemia. Además, pensamos que era necesario incluir muchos centros para obtener una muestra grande. Había dificultades para calcular el tamaño muestral dada la falta de datos previos de referencia. Son dificultades añadidas que nos encontramos al trabajar con una técnica emergente.
Por otra parte, la pregunta clínica surgía de las limitaciones de las técnicas habituales para diagnosticar adecuadamente a los pacientes con COVID-19 que salían de la UCI. Por ello nos planteamos técnicas emergentes.
Sí, además de la ecografía, incorporamos la bioimpedanciometría como segunda técnica de validación para así tener una visión tanto cuantitativa como cualitativa. Al principio, tuvimos dificultades para realizar las técnicas en los pacientes afectos de COVID-19 antes del alta hospitalaria (que era el momento basal), pero poco a poco fuimos trabajando de manera más fluida.
¿Cómo se planteó la necesidad de un grupo control en el estudio NUTRIECOMUSCLE?
El tipo de estudio que planteamos no es compatible con un diseño aleatorizado doble ciego, que es con el que se consigue el mayor grado de evidencia. Sin embargo, Clara tuvo la idea genial de hacer un grupo de control con pacientes con SDRA pero sin COVID para poder comparar fenotipos.
Sí, la idea era ver qué diferencias había en la recuperación entre pacientes con o sin COVID-19 tanto en el momento basal como en la recuperación, una vez apareados los pacientes por variables como edad, sexo, tipo de ventilación mecánica, etc. En mi opinión, creo que encontraremos diferencias entre estos dos tipos de pacientes.
Por otra parte, tuvimos algunas dificultades relacionadas con los comités de ética e investigación. Aunque con diferencias entre hospitales, cuando intentamos introducir una pequeña modificación en el estudio, las decisiones de los comités éticos se prolongaron y esto retrasó el inicio del estudio.
Respecto al grupo de control, nosotros decidimos que no tendríamos grupo de control y que asumiríamos que el primer corte de nuestra primera serie, es decir, nuestra práctica clínica habitual respecto a la disfagia y la desnutrición, sería nuestro nivel basal con el que compararíamos cualquier otra mejora a partir de esa primera intervención. En esos momentos nos organizamos para hacer una «foto» de lo que estaba ocurriendo y no tuvimos tiempo de estructurar una respuesta como tal. Por tanto, nuestro primer objetivo era hacer esa foto, que creemos que describe el impacto de la COVID-19 en un centro sanitario con respecto a la prevalencia y el pronóstico de la disfagia y la desnutrición. En las siguientes olas hemos ido introduciendo modificaciones en nuestro algoritmo de manejo que estamos analizando y que pensamos que suponen una mejora respecto al primer nivel de intervención. Es decir, el primer estudio es descriptivo. Nuestro segundo estudio, que estamos terminando, compara las tres olas, que son, además, fenotípicamente diferentes. Tenemos datos de la cuarte ola, que se comportó más como una meseta, y datos de la quinta ola que también queremos analizar.
Además, lo que también hemos hecho es acordarnos de un fenotipo que estudiamos siempre: los ancianos frágiles. En las tres olas que ya tenemos analizadas hemos estudiado qué ha pasado con los pacientes de más de sesenta años si los catalogamos por su índice de fragilidad. Puedo adelantar que el impacto de la COVID-19 en esta población ha sido enorme.
En resumen, hemos hecho un análisis de cinco olas, comparando la intervención que hemos hecho en cada ola, más un análisis fenotípico de un grupo que pensamos que debemos estudiar y que es el anciano frágil.
¿Qué comentarios se pueden hacer sobre el diseño, los materiales y métodos, y los criterios de inclusión y exclusión? ¿Algún comentario sobre la factibilidad de meter otras pruebas como biobanco, citoquinas, etc.?
Yo creo que ahí tenemos el reto del futuro. Los datos clínicos se están recogiendo pero, para profundizar aun más en la investigación traslacional, lo ideal sería analizar otras variables o muestras (p. ej., recogida prospectiva de muestras biológicas en el biobanco). La implicación de los comités de ética e investigación en la revisión de estos proyectos aumenta el valor del rigor de la misma. Se consolida la investigación traslacional como la investigación del futuro.
La factibilidad es un aspecto muy importante porque, en el diseño, «el papel lo aguanta todo», pero luego hay que llevarlo a cabo en la fase de campo.
Hay que dar las gracias al equipo humano (dietistas, logopedas, etc.), que se han ganado la complicidad del equipo puramente asistencial para realizar todo el cribado en 1500 pacientes. Han realizado un trabajo que hay que reconocer y son la clave del éxito del estudio. La parte de más valor de los métodos del estudio es el factor humano.
Me gustaría apuntar una curiosidad del estudio NUTRICOVID en Madrid. Cuando realizamos el cálculo del tamaño muestral, se indicó que debían seleccionarse solo 12 hospitales por ser realistas en la practicidad del estudio. Sin embargo, al presentar el proyecto en el grupo de trabajo de nutrición de la SENDIMAD, mostraron interés todos los profesionales del grupo, pertenecientes a 19 centros hospitalarios. Nutricia dio el apoyo para incluir todos los centros interesados y definitivamente han participado 16 centros. En este contexto, nos encontramos con dificultades administrativas y retrasos en la tramitación de las autorizaciones de los comités éticos. Los distintos comités tenían tiempos distintos en la ejecución de sus funciones. De hecho, un hospital no pudo participar porque, mientras esperaba las decisiones del comité ético, el personal investigador dejó de estar disponible. En resumen, la factibilidad se puede ver limitada por circunstancias inesperadas en un primer momento.
Con respecto a los comités éticos, además de los comités habituales, había comités específicos para proyectos sobre el COVID-19, por lo que había que pasar dos comités y esto alargaba el tiempo para iniciar el estudio.
A pesar de estos problemas hubo una ventana de oportunidad en ese sentido. Hubo un cambio muy rápido en la ley de ensayos clínicos que decretó, durante el tiempo en que estuvo declarado el estado de alarma, que los comités debían reaccionar en cuarenta y ocho horas dado el interés público de los estudios. Había semanas con numerosas reuniones de los comités para dar respuesta a todas las solicitudes. Incluso hubo una posibilidad legal que permitía conseguir el consentimiento a posteriori o de manera telemática. Acabada esta fase, volvimos a la realidad habitual.
En un diseño experimental de ensayo clínico es lógico evaluar el estudio desde el punto de vista ético, pues todo estudio alberga un riesgo. Pero para la investigación clínica debería existir una norma que permitiera evaluar los datos de forma agregada y sin necesidad de pasar por el comité ético cuando hacemos constar en la historia que tenemos la autorización del paciente.
¿Qué se puede decir sobre los aspectos económicos de la investigación?
La investigación es cara a corto plazo y baratísima a largo plazo. No hay más que ver que, en dos años, la humanidad ha conseguido fabricar una vacuna de última generación para la COVID-19, con el ahorro que ello supone. La investigación necesita financiación y los sanitarios tienen escasa formación en aspectos económicos. No saben cómo hacer un presupuesto para una investigación o cómo hacer una memoria económica que incluya el impacto de la investigación en términos de salud. También habría que enseñar cómo convencer a los gestores de la necesidad de la financiación y de los beneficios a largo plazo, pues los gestores son cortoplacistas.
Los aspectos económicos son algo que se aprende tarde, especialmente si no estás en grandes estructuras de investigación. Y la financiación es fundamental. Creo que en ese sentido, en concreto en la nutrición, la industria ha cogido el relevo. Ahora se ve España no como un mero país de consumo sino como una fuente de investigación de la máxima calidad.
¿Qué dificultades reales del día a día ha habido durante el desarrollo del estudio?
En nuestro estudio, por ejemplo, vimos que algún centro tuvo dificultades para reclutar pacientes cuando se abrieron centros específicos para pacientes con COVID-19. Por otro lado, el hecho de que muchos pacientes hubieran tenido estancias hospitalarias prolongadas con multitud de pruebas diagnósticas dificultaba la inclusión en el estudio, ya que algunos sujetos no querían someterse a pruebas complementarias extra. No obstante, la mayoría de ellos accedieron a participar una vez que iban comprendiendo el beneficio que podía reportar el estudio.
Siempre surgen dudas pero muchas las hemos resuelto de manera telemática entre los investigadores. En el día a día te das cuenta de detalles que no están en el protocolo y que hay que ir resolviendo, como los márgenes de días para hacer las revisiones cuando hay varios días de fiesta. También surgían dudas del manejo nutricional, el cual tenía que ser estándar en todos los centros.
En nuestro caso tuvimos la ventaja de contar con una CRO ( Contract Research Organization u organización de investigación por contrato) detrás del estudio, lo que ha facilitado el trabajo, la organización, la comunicación entre investigadores, etc. Han hecho un trabajo muy riguroso y ello ha permitido desarrollar el estudio de forma adecuada. Ha habido dudas: un hospital acabó retirándose, como ya hemos comentado; el reclutamiento fue más lento de lo esperado en algunos centros; hubo bajas de personal, etc., pero con la colaboración entre la CRO y las investigadoras se han ido superando las dificultades.
Nosotros hemos puesto un énfasis especial en cómo manejamos la gran cantidad de datos que generamos con cada paciente y el diferente origen de los mismos. Tenemos una historia clínica informatizada y hacíamos distintas pruebas, y todo eso había que pasarlo al cuaderno de recogida de datos (CRD), lo que supone un gran esfuerzo. La historia clínica no se comunica con el CRD y nosotros no contábamos con una CRO. El futuro pasa por conectar la ingente cantidad de datos que se pueden recoger de distintas maneras con un sistema único de gestión de datos. Es un tesoro que tenemos a nuestro alcance y que nos puede dar información muy valiosa. Nos puede hacer ver cómo cambian las enfermedades o cuál es el impacto de nuestros tratamientos.
Respecto a la publicación de los resultados, ¿cuál ha sido la planificación en ese sentido?
Nosotros, en el grupo de investigadores de NUTRICOVID, compartimos un documento que define la política de autorías y publicaciones. Ya hemos comunicado resultados en el congreso de la ESPEN; también comunicaremos en el congreso de la SENPE (Sociedad Española de Nutrición Clínica y Metabolismo) y, próximamente, en el congreso de la SEEN (Sociedad Española de Endocrinología y Nutrición). En el mes de noviembre lo haremos en el congreso de la propia SENDIMAD, que le dedicará un espacio en una mesa redonda. Además, ya está aceptado un artículo en Clinical Nutrition con datos preliminares ( 6 ). La idea es seguir publicando los datos definitivos y tal vez prolongar el proyecto para investigar las nuevas preguntas que van surgiendo.
En el estudio NUTRIECOMUSCLE aún estamos en fase de reclutamiento. Desde el principio se diseñó un reclutamiento competitivo y en las publicaciones estarán presentes todos los investigadores, dando mayor relevancia a aquellos con mayor número de pacientes.
Es importante que haya una política clara de publicación previa y nosotros hemos aprendido de otros estudios. En el orden de los autores hay que tener en cuenta el trabajo realizado en el estudio, el número de pacientes reclutados y la implicación en la escritura del artículo. Al final, el artículo en PubMed es como una foto de todo el proyecto y tiene que haber unas normas claras desde el principio.
ESTUDIO COVID-19-DN-OD EN EL HOSPITAL DE MATARÓ (CSDM)
El objetivo principal del proyecto era evaluar la prevalencia de la disfagia orofaríngea (DO) y la desnutrición (DN), las necesidades de tratamiento compensatorio y las complicaciones a los 3 y 6 meses de seguimiento de los pacientes ingresados por COVID-19 en el Hospital de Mataró (Consorci Sanitari del Maresme, CSdM), el cual es un hospital de tamaño medio (≈ 450 camas). En segundo lugar, determinar si los pacientes con OD y aquellos con OD y DN tienen peor pronóstico. En tercer lugar, evaluar el efecto terapéutico de una intervención multimodal basada en el tratamiento de la OD y la DN (manejo observacional en la primera ola frente a cribado y tratamiento en la segunda y la tercera ola, y en la fase de plateau posterior).
Los primeros datos se han publicado recientemente ( 1 ). La primera cohorte consta de 200 pacientes de la primera ola evaluados en 4 puntos: al ingreso, al alta y tras un seguimiento con control a los 3 y 6 meses. Como resultados, se puede destacar que más del 80 % de los pacientes con COVID-19 estaban en situación de riesgo de desnutrición y que eso impactó en la prevalencia de la desnutrición. El 45,5 % tenían desnutrición siguiendo los criterios GLIM. Pero lo más novedoso es la alta prevalencia de disfagia (51,7 %). Es un síntoma que hay que buscar, no solo preguntando al paciente sino buscando signos físicos. Además, la DO se asociaba a una disminución de la eficacia y de la seguridad de la deglución en una gran proporción de casos, lo que puede dar lugar a DN y a complicaciones respiratorias.
Las conclusiones del estudio indican que la DO es un factor de riesgo independiente para la DN durante la hospitalización, y que por ello hay que buscarla de forma activa. Además, la hospitalización se prolonga en los pacientes con DN en comparación con aquellos sin ella (21,9 ± 14,8 vs . 11,9 ± 8,9 días; p < 0,0001). Asimismo, la OD se asocia de forma independiente a comorbilidades, síntomas neurológicos y baja funcionalidad ( 1 ).
En el seguimiento se observó que la pérdida de capacidad funcional de los pacientes con DO sufrida durante el ingreso no se recuperaba posteriormente en los pacientes de la primera ola, en los cuales solo se hizo observación. Los parámetros antropométricos y bioquímicos tardaron hasta seis meses en recuperarse. Otra conclusión derivada de todos estos hallazgos es que la DO impacta en la supervivencia. Existe una diferencia muy significativa a los 6 meses entre los pacientes con o sin DO. La DO es un factor de riesgo independiente de mortalidad a los 6 meses, cosa que no ocurre con la desnutrición.
Con la primera ola también aprendimos que hay que ser todo lo precoces que se pueda. No hay que esperar a que el paciente esté desnutrido o manifieste signos de DO, pues ya se llega tarde. El cribado tiene que ser tan precoz como sea posible, debe incluir todos los fenotipos de pacientes, no solo los más graves, y enseguida hay que tratar a los pacientes con riesgo ( 7 ). La introducción de suplementos se hizo de forma sistemática en la segunda y la tercera olas, y fue muy bien aceptada por el personal de enfermería y por los pacientes. En comparación con la primera ola, en la segunda y la tercera olas, ya con un cribado y un tratamiento precoces, se ha observado una menor disminución del peso y una menor prevalencia final de la DO ( 8 ).
ESTUDIO MULTICÉNTRICO SOBRE LA EVOLUCIÓN DEL ESTADO NUTRICIONAL DE LOS PACIENTES CRÍTICOS SUPERVIVIENTES DE COVID-19 DURANTE LA PRIMERA OLA EN MADRID. ESTUDIO NUTRICOVID
Se trata de un estudio realizado en el marco de la Sociedad de Endocrinología, Nutrición y Diabetes de la Comunidad de Madrid (SENDIMAD) en el que han participado 16 hospitales de la Comunidad de Madrid. Es un estudio multicéntrico, ambispectivo y observacional que tiene como objetivo describir la evolución del estado nutricional en pacientes críticos supervivientes a la COVID-19 durante la primera ola de la enfermedad en la Comunidad de Madrid. En el momento de esta presentación, están recogidos los datos de alrededor del 60 % de los pacientes que han terminado un año de seguimiento.
Los criterios de inclusión fueron: 1) pacientes adultos con infección confirmada por COVID-19, ingresados en la UCI entre el de 1 de marzo y el 30 de junio de 2020; 2) posibilidad de seguimiento tras el alta hospitalaria por el grupo del estudio; 3) firma del consentimiento informado.
El tamaño muestral que se estimó al inicio del estudio fue de 207 pacientes, contando con un diez por ciento de pérdidas. El seguimiento se hacía al alta y a los 3,6 y 12 meses por medio de visitas telefónicas. Aquí se presentan brevemente solo los resultados al alta. Las variables analizadas incluían el cribado nutricional por medio del índice MUST, el cribado de la sarcopenia por medio del índice SARC-F, la funcionalidad por medio del índice de Barthel, la calidad de vida por medio del cuestionario EQ-5D, las comorbilidades, el cuidado nutricional y la mortalidad. Además se recogieron datos de los recursos sanitarios gastados durante la hospitalización, al alta y a los 12 meses.
Finalmente se reclutaron 176 pacientes, el 72 % varones, con una edad media de 60 ± 11 años (el 95 % del tamaño muestral calculado). Los resultados preliminares se han publicado recientemente ( 6 ). Destaca que, al ingreso, la proporción de pacientes con obesidad era del 60,2 % y que, al alta, la pérdida de peso fue del 17 %. Al alta, alrededor del 80 % de los pacientes tenían cierto grado de dependencia, valorada por el índice de Barthel. La proporción de pacientes con riesgo nutricional o riesgo de sarcopenia fue muy alta (MUST ≥ 2 y SARC-F ≥ 4 puntos en el 84 % y 87 % de los pacientes, respectivamente). A pesar de ello, la prescripción de un tratamiento médico nutricional se realizó solo en el 38 % de los pacientes. Hay que tener en cuenta que, dada la sobrecarga de trabajo de aquella época, algunos de estos datos se recogieron de forma retrospectiva. Los datos evaluados con las cinco dimensiones del cuestionario EQ-5D (movilidad, autocuidado, actividades de la vida diaria, dolor/molestias y ansiedad/depresión) indicaron una afectación grave de la calidad de vida al alta. La mediana de calidad de vida medida por una escala visual analógica (EVA) (100 = mejor salud imaginable; 0 = peor salud imaginable) fue de 40 (intervalo intercuartílico, IIC: 25-50). Respecto al uso de recursos sanitarios, la mediana de días en el hospital fue de 53 (IIC: 27-90) y la mediana de días en la UCI fue de 25 (IIC: 11-44). El 88 % de los pacientes requirieron ventilación mecánica invasiva (VMI) y el 54 % traqueostomía. Los datos a los 3 y 6 meses se presentarán próximamente.
PROYECTO NUTRIECOMUSCLE: APLICACIÓN DE LA ECOGRAFÍA EN LA EVALUACIÓN Y EL PLAN NUTRICIONAL DEL PACIENTE POST-UCI CON COVID U OTROS SÍNDROMES DE DISTRÉS RESPIRATORIO
En este caso, el estudio está en fase de reclutamiento y aún no se pueden presentar resultados.
El objetivo principal de este estudio es evaluar los posibles cambios de la composición corporal de los pacientes afectos de síndrome de distrés respiratorio del adulto (SDRA) a los 3 meses del alta hospitalaria, tras haber realizado un programa de intervención nutricional y de recuperación física que incluya un suplemento nutricional oral diseñado para la recuperación muscular y la rehabilitación motora.
Los objetivos secundarios incluyen evaluar posibles diferencias en la composición corporal y en la recuperación muscular al alta hospitalaria entre los pacientes ingresados en la UCI o semicríticos por SDRA por COVID-19 frente a los pacientes ingresados por SDRA en relación con otras patologías, apareados por sexo, edad, IMC, SOFA ( Sequential Organ Failure Assessment ), tipo de soporte ventilatorio (VMI, gafas nasales de alto flujo, etc.) e índice de Barthel previo al ingreso hospitalario.
Se trata de un estudio prospectivo multicéntrico en el que se incluyen pacientes que han precisado ingreso en la UCI por SDRA. Los criterios de inclusión fueron: 1) edad comprendida entre los 25 y los 75 años; 2) duración del ingreso en la UCI/semicríticos mayor o igual a 72 h; 3) que se incluyera en un programa de nutrición y recuperación funcional al alta hospitalaria. Los criterios de exclusión fueron: 1) pacientes gestantes; 2) pacientes que no otorguen su consentimiento; 3) pacientes con dificultades para la bipedestación con ayuda; 4) pacientes amputados; 5) pacientes que antes del ingreso presenten un índice de Barthel < 60 (dependencia severa); 6) pacientes con IMC previo mayor de 50 kg/m 2 . Los pacientes se dividieron en 2 grupos (COVID-19 y no COVID-19) en una proporción de 2:1. Todos ellos son valorados al alta hospitalaria, a los 45 días y a los 3 meses.
En el estudio participan 10 hospitales de toda la geografía española y el tamaño muestral estimado fue de 120 pacientes.
Al alta hospitalaria (visita basal), a todos los pacientes se les proporcionan recomendaciones dietéticas específicas, un suplemento nutricional oral específico para la recuperación muscular (100 % de lactoproteína sérica enriquecida con leucina y vitamina D); 2 envases al día repartidos entre las comidas) y recomendaciones de ejercicio físico.
Las variables analizadas en la visita basal y a los tres meses incluyen el estado nutricional, con valoración global subjetiva (VGS) y criterios GLIM, el índice de Barthel, una antropometría, una dinamometría, un test de la marcha, una ecografía nutricional, una impedancia bioeléctrica, el test de calidad de vida SF-12 y diversas analíticas con parámetros nutricionales y de inflamación. A los 45 días se hace una visita telefónica para confirmar la tolerancia al tratamiento y el cumplimiento con el suplemento nutricional.
Además, con la ecografía nutricional se evalúan la masa muscular a nivel del recto femoral anterior y el tejido adiposo abdominal, tanto el subcutáneo como el preperitoneal, que es equivalente al tejido visceral.
En el momento de esta presentación, el estudio estaba en fase de reclutamiento y había 70 pacientes incluidos. El periodo de reclutamiento finalizó el 31 de enero de 2021.
CONCLUSIONES FINALES
Dr. Gabriel Olveira Fuster
La investigación en nutrición clínica es indispensable para mejorar los resultados de salud. Es necesario fomentar una cultura de investigación y la formación continua en metodología de la investigación. Todos los profesionales sanitarios debemos reflexionar sobre la práctica clínica; somos importantes para realizar la investigación traslacional y, en ultima instancia, para mejorar la calidad de vida de los pacientes.
La COVID-19 ha cambiado nuestra vida y ha supuesto un reto sin precedentes para la investigación. Los proyectos como NutriCOVer son necesarios para seguir mejorando, reflexionando y cambiando nuestra práctica con el objetivo final de mejorar los resultados de salud de los pacientes, que al fin y al cabo son el centro de nuestra actividad.
BIBLIOGRAFÍA
1. Martin-Martinez A, Ortega O, Viñas P, Arreola V, Nascimento W, Costa A, et al. COVID-19 is associated with oropharyngeal dysphagia and malnutrition in hospitalized patients during the spring 2020 wave of the pandemic. Clin Nutr 2021;S0261-5614(21)00297-1. DOI:10.1016/j.clnu.2021.06.010 [ Links ]
2. Olveira Fuster G. Pilares para la excelencia en las unidades de nutrición:la investigación. Nutr Hosp 2021;38(N.º Extra 1):19-28. DOI:http://dx.doi.org/10.20960/nh.3557 [ Links ]
3. RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med 2021;384(8):693-704. DOI:10.1056/NEJMoa2021436 [ Links ]
4. Beigel JH, Tomashek KM, Dodd LE, Mehta AK, Zingman BS, Kalil AC, et al. Remdesivir for the Treatment of Covid-19 - Final Report. N Engl J Med 2020;383(19):1813-26. DOI:10.1056/NEJMoa2007764 [ Links ]
5. Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN. Retraction:Cardiovascular Disease, Drug Therapy, and Mortality in Covid-19. N Engl J Med 2020;382(26):2582. DOI:10.1056/NEJMc2021225 [ Links ]
6. Cuerda C, Sánchez López I, Gil Martínez C, Merino Viveros M, Velasco C, Cevallos Peñafiel V, et al. Impact of COVID-19 in nutritional and functional status of survivors admitted in intensive care units during the first outbreak. Preliminary results of the NUTRICOVID study. Clin Nutr 2021;S0261-5614(21)00526-4. DOI:10.1016/j.clnu.2021.11.017 [ Links ]
7. Cereda E, Clavé P, Collins PF, Holdoway A, Wischmeyer PE. Recovery Focused Nutritional Therapy across the Continuum of Care:Learning from COVID-19. Nutrients 2021;13(9):3293. DOI:10.3390/nu13093293 [ Links ]
8. Viñas P, Alarcón C, Martín AM, Costa A, Riera S, Ortega O, et al. Prevalence of oropharyngeal dysphagia and malnutrition among hospitalized patients with Covid-19 at the three waves of the pandemic. Clin Nutr ESPEN 2021;46:S623. DOI:10.1016/j.clnesp.2021.09.229 [ Links ]
Correspondencia: Gabriel Olveira Fuster. Servicio de Endocrinología y Nutrición. Hospital Regional Universitario de Málaga. Instituto de Investigación Biomédica de Málaga. Departamento de Medicina y Dermatología. Av. de Carlos Haya, 84. 29010 Málaga e-mail: [email protected]
Conflicto de intereses: los autores declaran no tener ningún conflicto de interés .


Consulte los artículos y contenidos publicados en este medio, además de los e-sumarios de las revistas científicas en el mismo momento de publicación
Esté informado en todo momento gracias a las alertas y novedades
Acceda a promociones exclusivas en suscripciones, lanzamientos y cursos acreditados
Estamos experimentado problemas con el acceso a las cuentas de usuarios. Disculpe la molestias
- He olvidado mi contraseña
- Contacte con nosotros

La REVISTA ESPAÑOLA DE NUTRICIÓN HUMANA Y DIETÉTICA es la revista científica de la Asociación Española de Dietistas-Nutricionistas (AED-N). Tiene como objetivo fundamental ser la revista líder en el campo de la nutrición humana y la dietética. Publica artículos científicos que han sido revisados de forma anónima por expertos en el tema. La revista, de periodicidad trimestral, publica artículos de investigación y de revisión en nutrición clínica y hospitalaria, dietética aplicada y dietoterapia, nutrición comunitaria y salud pública, nutrición básica y aplicada, educación alimentaria y sanitaria, restauración colectiva, social y comercial, tecnología culinaria y gastronomía, bromatología, toxicología y seguridad alimentaria, cultura alimentaria, sociología y antropología de la alimentación, cooperación humanitaria y, en definitiva, todas las áreas de la nutrición humana y la dietética. La REVISTA ESPAÑOLA DE NUTRICIÓN HUMANA Y DIETÉTICA se adhiere a los "Requisitos de uniformidad para manuscritos presentados para la publicación en revistas biomédicas" elaborados por el Comité Internacional de Editores de Revistas Médicas ( http://www.icmje.org ), por lo que los manuscritos deben elaborarse siguiendo sus recomendaciones.
Síguenos:
CiteScore mide la media de citaciones recibidas por artículo publicado.
SJR es una prestigiosa métrica basada en la idea de que todas las citaciones no son iguales. SJR usa un algoritmo similar al page rank de Google; es una medida cuantitativa y cualitativa al impacto de una publicación.
SNIP permite comparar el impacto de revistas de diferentes campos temáticos, corrigiendo las diferencias en la probabilidad de ser citado que existe entre revistas de distintas materias.

Introducción y antecedentes
En la práctica profesional diaria del dietista-nutricionista, es frecuente enfrentarse a un sinfín de preguntas acerca del uso de las recomendaciones dietético-nutricionales, a las cuales debe hallarse respuesta. Pese a que aún es habitual entre los profesionales sanitarios recurrir a la experiencia personal, o bien acudir a los libros de texto para solucionar dichas incógnitas 1,2 , cabe destacar que ésta podría no ser la forma más adecuada.
Esta forma de proceder no ha sido única en la historia. Tal y como explica Doherty 3 , en 1937, el joven médico Sir Richard Doll observó que en Londres los nuevos tratamientos surgían de la propia experiencia de los especialistas, sin tener en cuenta los factores de confusión ni los posibles sesgos 4 .
De esta forma, durante años la medicina fue incorporando la necesidad de crear la así llamada «medicina basada en la evidencia» para poder ofrecer la mejor práctica posible, hasta que en 1993 se publicaron, en el Journal of the American Medical Association, dos de los primeros documentos en que se usa el concepto de medicina basada en la evidencia 5-7 . Sin embargo, no es hasta 1995 cuando se define de forma explícita este concepto: «la forma sistemática de analizar los estudios científicos publicados para ser la base de los árboles de decisión clínica» 8 . Posteriormente, en 1996, Sacket et al 9 redefinieron el nuevo término como «el uso concienzudo y juicioso de la mejor evidencia científica actual derivada de la investigación en el manejo de pacientes individuales en atención clínica». En 1997 el National Center for Biotechnology Information (NCBI), basado en un artículo publicado en el British Medical Journal 10 , la introduce como «MeSH Term» —MeSH son las siglas de Medical Subject Headings (encabezados de materia médica) designados por National Library of Medicine de Estados Unidos— y la define como: «El proceso de encontrar, evaluar y usar, de manera sistemática, los hallazgos contemporáneos relativos a la investigación como la base en la toma de decisiones clínicas». Asimismo, se indica que la medicina basada en la evidencia sigue cuatro pasos: formulación de una cuestión clínica clara a partir de un problema médico, indagar en la literatura para hallar artículos clínicos relevantes, evaluar (valoración clínica) la evidencia desde el punto de vista de su validez y utilidad e implementar los hallazgos útiles en la práctica clínica 10 .
Como se puede apreciar, pese a que la medicina basada en la evidencia es un concepto bastante nuevo, el concepto sobre el cual se ha construido (los niveles de evidencia) es más antiguo. Ya en 1979, la Canadian Task Force on the Periodic Health Examination 11 elaboró una jerarquía para clasificar la evidencia. Dicha jerarquía consistía en la clasificación de los estudios científicos en 5 niveles de evidencia según el tipo de estudio realizado:
I. Ensayo clínico controlado, aleatorizado.
II.1. Ensayos clínicos controlados (sin aleatorización).
II.2. Estudios de cohortes o estudios analíticos de caso-control.
II.3. Estudios de series de tiempo múltiples con o sin intervención.
III. Opiniones de expertos, experiencias clínicas, estudios descriptivos u opiniones de comités de expertos.
Posteriormente se han publicado otras jerarquías 12,13 , todas ellas basadas en una clasificación de los diferentes tipos de estudios según el nivel de evidencia, y se establecieron los grados de recomendación correspondientes. En 1996, la US Preventive Task Force, como se aprecia en la tabla 1 14 , añadió a los niveles de evidencia de la Canadian Task Force on the Periodic Health Examination 11 un sistema de clasificación de la solidez de las recomendaciones que dichas evidencias proporcionan.

En una revisión de 1.602 artículos realizada por la Agency for Healthcare Research and Quality de la US Department of Health and Human Services en 2002, se detectó el uso de hasta 120 sistemas diferentes de clasificación de la evidencia científica y de calidad de los estudios 15 .
De esta forma, paralelamente al desarrollo de los niveles de evidencia, ha ido creciendo la medicina basada en la evidencia. En la figura 1 se observa el crecimiento lineal (R 2 = 0,9835) de los nuevos estudios publicados cada año en PubMed en torno a la medicina basada en la evidencia.
Fig. 1. Resultado de la introducción de «evidence based medicine» en PubMed por años. Nuevos artículos acerca de la medicina basada en la evidencia por año (elaboración propia).
De la misma forma que la medicina basada en la evidencia ha evolucionado y actualmente determina la práctica clínica, la dietética y la nutrición aplicada basadas en la evidencia (DNABE) debe hacerlo también, y dictar cuál es la mejor práctica dietético-nutricional.
Existen iniciativas cuyo objetivo es ayudar a los dietistas-nutricionistas a desarrollar e implementar guías basadas en la evidencia. Es el caso de la iniciativa del departamento de dietética de la División de Rehabilitación y Nutrición del Centro Médico Universitario Utrecht NL 16 , en 1998, o la iniciativa de la American Dietetic Association (ADA) 17 de poner a disposición de sus socios, en 2006, una librería de análisis de la evidencia desde donde se puede acceder a las guías más importantes de la práctica dietética basada en la evidencia. En cualquier caso, no se ha hallado ningún estudio que describa, de forma detallada, un método práctico de sistematizar la clasificación de los niveles de evidencia y la solidez de sus recomendaciones en el campo de la dietética y la nutrición humana aplicada.
Es, por tanto, la finalidad del presente documento iniciar el proceso de creación de la DNABE en España, y ofrecer una metodología práctica para que los dietistas-nutricionistas, así como cualquier otro profesional sanitario cualificado, puedan ofrecer recomendaciones actuales, útiles, válidas y sólidas en el campo de la dietética y la nutrición humana aplicada.
Sistema para establecer la solidez de un conjunto de artículos que conformen la evidencia científica
Uno de los mayores problemas actuales es que hay muchos estudios, y de muchos tipos, que nos pueden ofrecer diferentes respuestas o incluso contradictorias. Esto puede hacer difícil al profesional discernir cuál es «la verdad» o en qué medida una recomendación se «acerca a la verdad».
En este sentido, cuando hay un conjunto de artículos de los que se quiere conocer a cuál o cuáles de ellos se debe tener en mayor consideración para realizar una recomendación, hay que tener en cuenta 3 aspectos principales: el tipo de diseño de estudio, la calidad individual de los estudios 18 y la cantidad relativa de muestra de población 19 , así como la duración del estudio. Estos aspectos se detallan a continuación.
Importancia del diseño del estudio
Para clasificar los estudios dentro de una jerarquía de niveles de evidencia y grados de recomendación, es necesario determinar el diseño del estudio. Según su diseño podríamos diferenciar cuatro grandes grupos de estudios: experimentales, observacionales, de revisión y de consenso o posicionamiento.
Los estudios experimentales se caracterizan por tener un grupo llamado «intervención», que se somete a un tratamiento, mientras que los estudios observacionales se caracterizan por observar y examinar la relación entre los factores específicos de un grupo de población y los factores o marcadores de salud o enfermedad 20 . Por otro lado, los estudios de revisión, consenso y posicionamiento pueden ser muy heterogéneos, ya que pueden abarcar desde revisiones de la literatura de cualquier tipo (libros, artículos de revistas científicas, páginas de internet, etc.) hasta revisiones de artículos científicos de un diseño específico (por ejemplo, de ensayos clínicos controlados, aleatorizados).
Entre los estudios experimentales, se puede distinguir 21 :
1. Ensayos clínicos controlados, aleatorizados (ECCA, o sus siglas inglesas RCT: randomized controlled trial ): trabajos consistentes en un ensayo clínico que involucre, como mínimo, un grupo de intervención y un grupo control, asignación simultánea, y seguimiento de ambos grupos. Asimismo, los tratamientos a administrar se seleccionan por un proceso aleatorio.
2. Ensayos clínicos controlados (no aleatorizados): trabajos consistentes en ensayos clínicos que involucren, como mínimo, un grupo de intervención y un grupo control, y que especifiquen las medidas de los parámetros para la intervención estudiada, mediante un método libre de sesgos para asignar a los pacientes al tratamiento. Los tratamientos podrían ser fármacos, aparatos o procedimientos estudiados para valorar la efectividad del diagnóstico, la terapia o la profilaxis. Las medidas de control incluyen placebos, sustancia activa, no tratar, dosis utilizada y regímenes, comparaciones históricas, etc.
3. Ensayos clínicos (no controlados): trabajos consistentes en estudios clínicos prediseñados acerca de la seguridad, la eficacia o la planificación de la dosis óptima de uno o más fármacos, instrumentos o técnicas para realizar diagnósticos, terapias o profilaxis en humanos seleccionados en función de criterios predeterminados de elegibilidad y observados por evidencias previamente determinadas de efectos favorables o no favorables.
Entre los estudios observacionales 21 :
1. Estudios de cohortes: estudios en los que se identifican subgrupos de población. Estos grupos pueden ser o no expuestos a factores que hipotéticamente podrían influir en la probabilidad de que ocurra una enfermedad en concreto u otro acontecimiento. Las cohortes son poblaciones definidas que, como grupo, se siguen con el objetivo de determinar características distintivas en subgrupos.
2. Estudios de casos-control: estudios que se inician con la identificación de personas con una enfermedad de interés y con un grupo control (comparación o de referencia) sin la enfermedad. Se examina la relación de un atributo con la enfermedad comparando a las personas enfermas y las no enfermas en relación con la frecuencia o los niveles del atributo en cada grupo.
3. Estudios transversales: estudios en que se valora la presencia o ausencia de una enfermedad, o de otras variables determinadas, en cada miembro de la población de estudio o en una muestra representativa de dicha población, en un momento dado.
Entre los estudios de revisión 21 :
1. Metaanálisis: trabajos que consisten en la valoración de estudios con un método cuantitativo mediante la combinación de resultados de estudios independientes (normalmente extraídos de lo publicado en la literatura científica) y sumarios sintetizados y conclusiones que podrían utilizarse para evaluar el efectividad terapéutica, planificar nuevos estudios, etc.
2. Revisión sistemática 22 : una revisión de una cuestión claramente formulada, que utiliza métodos sistemáticos y explícitos para identificar, seleccionar y criticar estudios relevantes, y para recoger y analizar información incluida en la revisión. Se puede o no usar métodos estadísticos (metaanálisis) para analizar o sintetizar los resultados de los estudios que se hayan incluido.
3. Revisión: un artículo o libro publicado tras el examen de material publicado acerca de un tema. Puede ser exhaustiva, a varios niveles, y el intervalo de tiempo seleccionado para captar estudios puede ser amplio o estrecho, pero las revisiones más solicitadas son las que evalúan la literatura actual.
No todos los estudios tienen la misma finalidad. Por ejemplo, se considera que los ECCA son los estudios que estiman «la verdad» de forma más precisa 23 , mientras que los estudios de casos clínicos, se considera que son más útiles para generar hipótesis 24 . Entre estos dos tipos de diseño están los estudios de cohortes y los estudios de casos-control. Los primeros ayudan a crear una relación entre un factor de riesgo y una consecuencia potencial, mientras que los segundos a menudo son utilizados para identificar los factores que pueden pronosticar una posible consecuencia 23,24 . Los estudios de casos-control son más susceptibles a tener algún tipo de sesgo que los estudios de cohortes 25 .
Por un lado, la US Agency for Health Care Policy and Research (AHCPR) estableció en 1996 que, en los casos en que no es posible realizar ECCA, o bien éstos no son capaces de proporcionar la respuesta adecuada, se puede igualar el valor científico de estudios observacionales y de ECCA. La jerarquía propuesta por esta agencia está basada en 7 niveles de evidencia que se corresponden a 3 grados de recomendaciones diferentes 19 .
Por otro lado, investigadores del Instituto Alemán de Medicina Social, Epidemiología y Economía de la Salud y el Departamento de Epidemiología del Instituto Alemán de Nutrición Humana han puesto de manifiesto que cuando se realizan recomendaciones preventivas a la población con consejos para mejorar conductas, sin especificar cantidades (por ejemplo, recomendar el aumento del consumo de frutas y verduras sin establecer una cantidad bien definida), o eliminar conductas perniciosas (hábito de fumar o consumo de alcohol), no es necesario que se diseñe un ECCA para comprobarlo, sino que con estudios observacionales es suficiente para llegar a la conclusión 26 .
Muchos autores han desarrollado sus propias jerarquías de niveles de evidencia. En este sentido, se ha utilizado la base de datos del National Guideline Clearinghouse (base de datos pública que ofrece acceso a guías de práctica clínica basada en la evidencia, creada por la Agency for Healthcare Research and Quality [AHRQ], US Department of Health and Human Services, y en su origen, por la American Medical Association y la American Association of Health Plans) para encontrar estudios que usen un sistema de jerarquía de la evidencia en el marco de la nutrición basada en la evidencia ( evidence based nutrition; EBN). Debido a las limitaciones del buscador de esta base de datos, se ha utilizado Google como motor de búsqueda dentro de la misma base de datos (para más información al respecto, consultar Baladia et al 27 , 2006). Únicamente se han hallado 2 documentos que cumplan con los requisitos establecidos: la «Guía práctica basada en la evidencia de los desórdenes en el metabolismo de los lípidos» 28 y los «Estándares en el cuidado médico en la diabetes» 29 , de los cuales únicamente el segundo establece de forma clara una jerarquía de niveles de evidencia en sus recomendaciones (tabla 2).
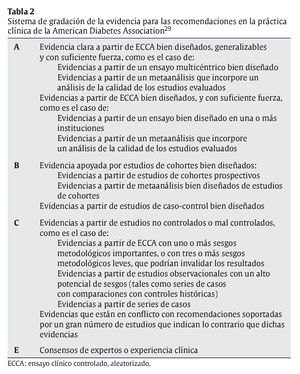
Se han hallado, además, otras guías que, pese a no especificar que son de nutrición basada en la evidencia, tratan sobre el manejo dietético-nutricional en distintas enfermedades crónicas: obesidad 30 , enfermedad cardiovascular 31 , osteoporosis 32 y salud dental 33 .
De esta forma, tomando como base únicamente el tipo de diseño de estudio, y según lo descrito en este apartado, se puede resumir y establecer un esquema general de jerarquía de los niveles de evidencia:
- Revisión sistemática con trato estadístico de ECCA. - Metaanálisis de ECCA. - Revisión sistemática de ECCA (sin trato estadístico). - Revisiones de ECCA. - ECCA independientes. - Revisiones sistemáticas con trato estadístico de estudios de cohortes prospectivos. - Metaanálisis de estudios de cohortes prospectivos. - Ensayos clínicos controlados (sin aleatorización): dentro de éstos, y por este orden: revisión sistemática con trato estadístico, metaanálisis, revisión e independientes. - Revisiones de estudios de cohortes prospectivos. - Estudios de cohortes prospectivos independientes. - Estudios de casos-control (control no histórico): dentro de éstos, y por este orden: revisión sistemática con trato estadístico, metaanálisis, revisión e independientes. - Ensayos clínicos no controlados. - Estudios de cohortes con control histórico. - Estudios de casos-control (con control histórico). - Estudios transversales. - Estudios controvertidos: estudios de diseño parecido o bien muchos estudios de diseño inferior refutados por poca cantidad de estudios de diseño de calidad superior. - Opiniones de expertos: en caso de que éstos aporten estudios, se clasificará según su diseño. - Otros tipos de revisiones. - Otros documentos.
A estos niveles de evidencia, les debe corresponder unos grados de recomendación o solidez de la recomendación:
- Recomendaciones cuya variación a lo largo del tiempo es altamente improbable. - Recomendaciones cuya variación a lo largo del tiempo es improbable. - Recomendaciones que es probable que varíen a lo largo del tiempo. - Hay estudios limitados o no están sustentados en suficientes estudios. No se puede establecer recomendación. - No se han hallado estudios al respecto.
Pese a que el diseño de un estudio es muy importante para definir la evidencia científica que nos aporta la afirmación que se baraja en su hipótesis, hay que tener en cuenta los otros dos aspectos para establecer una buena jerarquía de niveles de evidencia y grados de solidez de las recomendaciones 15 , descritos a continuación.
Sistema para estimar la calidad individual de los artículos
Aparte de establecer una jerarquía entre los distintos tipos de diseño de estudios, también es posible establecer un sistema jerárquico dentro de un mismo tipo de estudio para permitir que los estudios de mayor calidad estén por encima de los de peor calidad; de esta forma se obtiene una mayor fiabilidad de las recomendaciones que se desprendan de dichos estudios, y se pueden evitar posibles sesgos o errores de interpretación. Según el Center of Reviews and Dissemination (CRD) de la Universidad de York (Reino Unido) 25 , es posible que los estudios de baja calidad tiendan a sobrestimar el efecto del tratamiento 34 , o incluso pueden llegar a conclusiones contrarias a las halladas por estudios de alta calidad 35 .
Hay muchos puntos que se podría considerar para definir la calidad de un artículo. Tal y como muestra la tabla 3, un documento, aceptado por la Agency for Healthcare Research and Quality de la US Department of Health and Human Services en 2002, considera entre 9 y 11 dominios (por cada tipo de diseño de estudio) que pueden ser revisados cuando se intenta definir la calidad de un artículo 15 . Se puede apreciar que se han destacado los 19 dominios que se consideraron «críticos» para establecer dicha calidad.
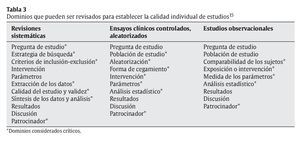
Según señalan los autores de ese documento, para definir la calidad de un artículo se pueden usar los 9-11 dominios o solamente los indicados como críticos. Asimismo, advierten que debe tenerse siempre en consideración que, según el sistema elegido para establecer la calidad, puede aumentar tanto la dificultad de uso que disminuya su practicidad y su precisión 15 .
Estudios experimentales
En el apartado «Importancia del diseño del estudio», se ha podido comprobar que los ECCA ocupan los primeros lugares en la jerarquía del tipo de diseño. Sin embargo, no todos los ECCA son de igual calidad o igual de fiables. Como se puede observar en la tabla 3, hay 7 dominios críticos que pueden ser revisados para determinar la calidad de los ECCA. Sin embargo, para mantener la practicidad, algunos autores han descrito que para definir la calidad de los ECCA es aceptable usar, como mínimo, los siguientes indicadores: la aleatorización, el análisis estadístico y la forma de cegamiento 19,36-38 , es decir 3 de los 7 descritos como críticos en la tabla 3. Una revisión realizada en 1995 por Moher et al 38 identificó 25 escalas de puntuación diferentes para definir la calidad de ECCA. Los autores identificaron, de cada una de las escalas, una serie de características para poder evaluar su calidad. Entre otras, se describió:
1. Si podía medir ECCA de cualquier materia, o bien, estaba especializada, por ejemplo, en alguna patología.
2. Si se refería a la calidad metodológica o a la calidad total del artículo.
3. Si había como mínimo un ítem para identificar la asignación de los pacientes.
4. Si había como mínimo un ítem acerca del enmascaramiento.
5. Si había como mínimo un ítem acerca del seguimiento del paciente.
6. Si se hacía un análisis estadístico.
7. El número de ítems a responder.
8. El tiempo necesario para completar dicha escala.
Pese a que los autores concluyeron que únicamente la escala de Jadad-Bechara 39 superó todo el examen propuesto, cabe destacar que la Cochrane Collaboration indica que no existe el estándar en el uso de dichas escalas para establecer la calidad de los estudios 40 , y que no están soportadas por evidencia empírica 41,42 . La misma organización recomienda que, en caso de usarlas, se haga con cautela. Los autores del presente artículo quieren recalcar, por tanto, que pueden existir otros sistemas que ofrezcan mayor fiabilidad en la evaluación de la calidad de los estudios, pero también advierten que establecer otro tipo de metodología para evaluar la calidad de los estudios podría requerir una mayor inversión de tiempo y mejores conocimientos en bioestadística. Es por ello que se aconseja usar, conociendo las limitaciones del sistema, alguna de las citadas escalas de calidad detalladas por Moher et al 38 , antes que no usar ningún sistema para evaluar la calidad individual de los estudios. Como el actual documento pretende ser una herramienta práctica que sirva para evaluar de forma rápida la calidad de ECCA de cualquier materia, se ha valorado cualitativamente cada uno de los 8 puntos que caracterizan las diferentes escalas 38 para determinar cuál de ellas puede ser la más adecuada.
Pese a que hay muchas escalas, con múltiples ítems y complejos sistemas de puntuación que pueden hacer que el evaluador invierta mucho tiempo en contestarlos, no se ha comprobado que dichas escalas ofrezcan mayor validez que otras más sencillas 43 . Por tanto, tras revisar las 25 escalas de puntuación del estudio de Moher et al 38 , la escala de Detsky et al 36 parece ser la que mejor se adapta a las necesidades de los lectores del presente artículo. Dicha escala sirve para evaluar ECCA de cualquier materia y se refiere tanto a la calidad metodológica como a la calidad general del artículo. Hay, como mínimo, un ítem para identificar la asignación de los pacientes y otro acerca del enmascaramiento. Asimismo, hay, como mínimo, un ítem para evaluar el análisis estadístico, y es uno de los que más rápidamente se puede contestar (aproximadamente en 10 min) (tabla 4). Además, tal y como detallan Petrisor et al 18 , el sistema desarrollado por Detsky et al 36 es un método validado. Otros estudios posteriores han usado dicha escala para evaluar, con éxito, ECCA de distintas materias 44-46 .
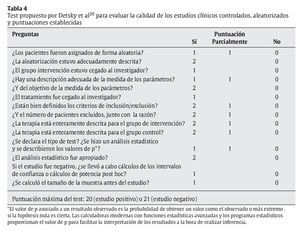
Esta puede ser, por tanto, una forma práctica de clasificar los ECCA según el porcentaje de cumplimiento respecto al total de puntos obtenidos en el test de Detsky et al 36 .
Otra forma de determinar la calidad individual de un estudio es mediante las listas de control sin puntuaciones o cheklists. El Center of Reviews and Dissemination (CRD) usa como ejemplo los 9 ítems del Consenso de Delphi (Verhagen et al 47 ):
1. ¿Realmente la asignación del tratamiento a los grupos fue aleatoria?
- Enfoques apropiados para la generación de secuencias: a) números aleatorios generados por computadora, y b) tablas de números aleatorios.
- Enfoques inapropiados para la generación de secuencias: uso de alternancias, números de historia clínica, fechas de nacimientos, días de la semana, etc.
2. ¿Se ocultó la asignación al tratamiento?
- Enfoques apropiados del enmascaramiento de la aleatorización:
a) aleatorización centralizada o controlada; b) contenedores numerados con secuencias idénticas; c) sistema computarizado con una secuencia aleatoria no legible hasta la asignación, y d) otros enfoques con métodos sólidos para prevenir el reconocimiento de la secuencia de asignación por parte de los investigadores o los pacientes.
- Enfoques inapropiados del enmascaramiento de la aleatorización: a) uso de alternancias, números de historia clínica, fechas de nacimientos, días de la semana, etc.; b) listas legibles de números aleatorios, y c) envases numerados con secuencias (incluso los envases opacos sellados pueden estar sujetos a manipulaciones).
3. ¿Los grupos eran similares al inicio del estudio en términos de factores pronóstico?
4. ¿Se especificaron los criterios de inclusión?
5. ¿Hubo ciego simple (paciente), doble ciego (investigador) o triple ciego (quien analiza los datos)?
6. La estimación puntual y la medida de la variabilidad ¿fueron presentadas para la variable de valoración predefinida (es decir, la de mayor importancia y la que en un estudio habitualmente determina el tamaño muestral)?
7. ¿Incluyeron los análisis una evaluación por intención de tratamiento?
También, en este caso, se podría clasificar los ECCA según el porcentaje de respuestas favorables o negativas a dicho checklist.
Estudios observacionales
Para los estudios observacionales, la Agency for Healthcare Research and Quality de la US Department of Health and Human Services concluye que para poder inferir un resultado válido a partir de estudios observacionales, los investigadores deben asegurar, como mínimo, la comparabilidad entre los grupos de estudio (exceptuando los factores que están bajo estudio), y garantizar que se haya hecho un adecuado análisis estadístico de los resultados 15 .
Asimismo, el Center of Reviews and Dissemination señala que los estudios de cohorte que usan datos históricos para comparar con el grupo de estudio actual, son vistos, generalmente, como de menor calidad que aquellos que comparan dos grupos actuales, y añade, además, que los estudios prospectivos acostumbran a tener menor riesgo de sesgos que los estudios retrospectivos 25 .
Pese a que existen distintos cheklists para la evaluación de la calidad individual de estudios epidemiológicos, como, por ejemplo, el propuesto por Levine et al 48 , el Center of Reviews and Dissemination propone una fusión de distintos cheklists 25 :
1. Estudios de cohortes:
- ¿Hay suficiente descripción de los grupos y de la distribución de los factores de pronóstico? - ¿Los grupos se agruparon en función de la similitud en la progresión de su enfermedad? - ¿Se estableció formalmente la intervención o el tratamiento? - ¿Los grupos son comparables en relación con todos los factores de confusión? - ¿Se ajustaron adecuadamente los efectos de dichos factores de confusión? - ¿Hay una relación dosis-respuesta entre la intervención y los resultados? - ¿La persona que analiza fue cegada en referencia a la intervención? - ¿El seguimiento fue lo suficientemente largo como para que tuviesen lugar los resultados? - ¿Qué proporción de la cohorte fue seguida? - ¿La tasa de abandono y sus causas fueron similares entre los grupos intervención y control?
2. Estudios de casos y controles:
- ¿Es explícita la definición del grupo «caso»? - ¿Se ha valorado y validado correctamente el estado de la enfermedad de los «casos»? - ¿Se aleatorizó a los grupos control a partir de la fuente de población de los «casos»? - ¿Son comparables los casos y los controles con respecto a los potenciales factores de confusión? - ¿Se valoró de la misma manera las intervenciones y otras exposiciones tanto en los casos como en los controles? - ¿Cómo se definió la tasa de respuesta? - ¿Las tasas de falta de respuesta y sus razones fueron iguales en ambos grupos? - ¿Es posible que haya habido un sobreemparejamiento en cuanto a la asignación de los casos y los controles a los factores relacionados con la exposición? - ¿Se realizó un análisis estadístico apropiado? (emparejado o no emparejado).
3. Series de casos:
- ¿El estudio se basa en una muestra representativa seleccionada de una población relevante? - ¿Los criterios de inclusión son explícitos? - ¿Todos los individuos empezaron la investigación en un punto similar de la progresión de su enfermedad? - ¿El seguimiento fue lo suficientemente largo como para que ocurriesen eventos importantes? - ¿Los parámetros se valoraron siguiendo criterios objetivos o se utilizó un método de cegamiento? - Si se han hecho comparaciones de subgrupos, ¿hubo suficiente descripción de las series y de la distribución de los factores pronóstico?
Otros criterios aplicables a todos los tipos de estudios
Además de los dominios descritos en los apartados correspondientes a cada tipo de diseño de estudio, también se puede verificar, como propone la Agency for Healthcare Research and Quality de la US Department of Health and Human Services 14 : los patrocinadores y los conflictos de intereses.
Por tanto, entre estudios de igual diseño, la calidad individual puede hacer que los de más calidad estén, científicamente hablando, por encima de los estudios de menor calidad. De la misma forma, estudios de mala calidad que teóricamente ofrecerían, según su diseño, mayor nivel de evidencia, puede que estén por debajo de otros que serían de calidad científica inferior. A este respecto no se ha hallado ningún estudio que establezca de forma clara a partir de qué puntuación se puede decir que un estudio es de menor calidad individual que otro. Vista la falta de información, los autores del presente documento proponen clasificar la calidad de los estudios, de forma transitoria hasta tener más datos, de la siguiente manera:
- Calidad alta: estudios cuya puntuación o porcentaje de cumplimiento de las escalas establecidas en este punto supere el 75%. - Calidad media: cuya puntuación o porcentaje de cumplimiento de las escalas establecidas en este punto estén entre el 50 y el 75%. - Calidad baja: cuya puntuación o porcentaje de cumplimiento de las escalas establecidas en este punto estén por debajo del 50%.
Así, ¿cómo puede afectar la calidad de un estudio individual a la jerarquía de niveles de evidencia? Se propone que las recomendaciones procedentes de estudios de calidad media tengan un formato igual o similar al siguiente: «hay pocos estudios o las conclusiones no están sustentadas en suficientes estudios. No se puede establecer una recomendación», mientras que los estudios de calidad baja automáticamente serán desechados.
Cantidad relativa de muestra de población y duración de la intervención
La cantidad de muestra de población de los estudios también es uno de los factores que debe tenerse en cuenta para establecer el peso que se le tiene que dar a dicho estudio. Hay sistemas para establecer el tamaño de muestra que debe usarse según las características del estudio. Pese a que la explicación de dichos sistemas excede los objetivos fijados para esta revisión, cabe resaltar que la US Agency for Health Care Policy and Research clasifica los ECCA de menos de 100 pacientes como estudios de menor evidencia científica 19 . Es decir, que entre estudios de igual diseño, y cuya calidad individual sea parecida, serán de mayor calidad científica aquellos que tengan una muestra mayor de población.
En este sentido, cuando se comparan estudios de diseño distinto, cabe destacar que los estudios observacionales y los metaanálisis, por sus características, pueden tener una mayor cantidad relativa de muestra de población respecto a los ECCA. Esto no implica que dichos estudios sean directamente de mayor calidad que los ECCA. Únicamente los metaanálisis de ECCA, con su correspondiente análisis estadístico bien realizado, serán de mayor evidencia científica que los ECCA de más de 100 pacientes de forma individual. Sin embargo, las revisiones sistemáticas con trato estadístico o metaanálisis de estudios de cohortes prospectivos podrán ser de igual evidencia científica que los ECCA con menos de 100 pacientes 18,19 .
De igual forma, al comparar estudios de igual diseño, calidad individual parecida y tamaño de muestra parecido, serán de mayor calidad científica aquellos cuya duración de la intervención sea mayor.
Conclusiones. Creando una metodología
Actualmente existe la necesidad de que el dietista-nutricionista, o cualquier otro profesional que se dedique a la dietética y nutrición aplicada (tanto clínica como comunitaria), utilice la DNABE en sus métodos para obtener guías de práctica clínica que incorporen recomendaciones basadas en la evidencia científica 49-51 .
Considerando los tres dominios principales (el tipo de diseño de estudio, la calidad individual de los estudios 18 y la cantidad relativa de muestra de población 19 y la duración del estudio), se recomienda la siguiente metodología de trabajo para crear dichas recomendaciones:
1. Definir la pregunta o cuestión a tratar: cuanto más abierta, más difícil será recuperar (mediante una estrategia de búsqueda) estudios relevantes. Pero si la pregunta es demasiado concisa, se podría estar dejando de lado consideraciones potencialmente importantes en la decisión final 40 .
2. Ejecutar una correcta estrategia de búsqueda a través de una base de datos especializada. Para más información se propone consultar el artículo: «Introducción a la búsqueda de información en internet de interés para dietistas-nutricionistas (2): bases de datos electrónicas especializadas, el primer paso hacia la evidencia científica» 52 .
3. Agrupar los estudios según su diseño:
- Experimental: ECCA, estudio clínico controlado (no aleatorizado) o estudio clínico (no controlado). - Observacional: estudio de cohortes (identificar si es prospectivo o retrospectivo), estudio caso-control o estudio transversal. - De revisión: revisión sistemática (con o sin trato estadístico), metaanálisis o revisión. - Otros: documentos de consenso, posicionamiento u otros tipos. Tanto en los artículos de revisión como en otros hay que establecer si dichos estudios han seleccionado ECCA, o bien, en su caso, identificar el tipo de estudio observacional.
4. Establecer la calidad individual de los estudios según lo descrito en el apartado «Sistema para estimar la calidad individual de los artículos» en: alta, media o baja.
- ECCA (usar ambos sistemas): sistema de Detsky et al 36 y sistema de consenso Delphi 47 . - Observacionales: sistema del CRD 25 (véase el apartado «Sistema para estimar la calidad individual de los artículos», concretamente el subapartado «Estudios observacionales»). - Todos 15 : patrocinadores y conflictos de intereses. Desechar los estudios de calidad baja.
5. Clasificar la evidencia según la jerarquía descrita en la tabla 5.
6. Dentro de cada uno de los tipos de diseño de un estudio, ordenar por cantidad de muestra y tiempo que dura la intervención u observación.
7. Crear la recomendación, añadiendo una frase que identifique el espíritu del grado de recomendación.
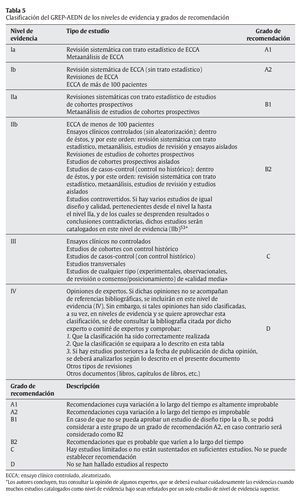
Reflexiones finales
Tal y como indica Doherty 3 , pese a que la medicina basada en la evidencia se ha ido consolidando, con el objetivo de disminuir fuentes de error en la elección del tratamiento o para prevenir la prescripción de tratamientos peligrosos, hay algunos estudios contemporáneos que indican que más del 25% de los pacientes aún reciben tratamientos que les podrían perjudicar 54 , y que más de un 40% no recibe tratamientos de comprobada efectividad 55 .
Según Doherty 3 , hay algunas razones para que las buenas evidencias no sean realmente adoptadas en la práctica clínica 56 . Éstas se pueden resumir en:
- Características de la propia evidencia (por ejemplo, la dificultad de realizarla).
- Barreras o resistencias en la capacidad de adopción de la evidencia, que se pueden dar en el paciente, el profesional, el grupo de trabajo, la institución y otros.
- Transferencia inadecuada de la evidencia al paciente o también llamada «traducción errónea del conocimiento».
Con el presente documento se ha propuesto un sistema para poner en marcha la dietética y la nutrición aplicada basadas en la evidencia en España. Ha sido la intención de los autores crear una herramienta práctica para que los dietistas-nutricionistas puedan involucrarse en dicha tarea y así mejorar el nivel de sus recomendaciones, sin caer en la primera de las barreras que pueden existir a la hora de aplicar las buenas evidencias: un sistema excesivamente complicado.
Investigaciones futuras deberán establecer si se ha podido implementar el sistema propuesto de niveles de evidencia y, en todo caso, establecer cuáles han sido los puntos fuertes o frágiles del sistema planteado.
Correspondencia: E. Baladia. Consell de Cent, 314, pral. B. 08007 Barcelona. España. Correo electrónico: [email protected]
Historia del artículo: Recibido 11-4-2008. Aceptado 11-4-2008.
- Suscríbase a la newsletter
- Enviar a un amigo
- Exportar referencia
- Estadísticas
- Número actual
- Todos los números
- Archivo 1997-2007
- Alcance y objetivos
- Lo más leído
- Todas las métricas
- Call for papers
- Artículos más leídos
- Colecciones
- Fondo editorial
- Más información
- Descargar PDF
- Bibliografía

IMAGES
COMMENTS
Los estudios experimentales son un grupo de diseños de investigación que se usan generalmente para evaluar alguna medida terapéutica; sin embargo, con estos diseños también se evalúan otro tipo de intervenciones. Como intervención(es) en el área clínica nos referimos a la(s) acción(es) dirigida(s) a modificar uno o más condiciones de ...
La respuesta es simple: el más adecuado para responder a la pregunta de investigación formulada. Existen estudios descriptivos, observacionales (muy útiles en Nutrición Aplicada), cuasi-experimentales y experimentales, incluido el ensayo clínico aleatorio, y, al final del espectro, el metaanálisis fruto de la revisión sistemática.
En un estudio experimental relacionado con la nutrición (también conocido como estudio clínico o estudio de intervención), los investigadores proporcionan a los participantes una dieta, educación sobre nutrición u otro tipo de intervención, y evalúan sus efectos. ... En cambio, es probable que los estudios experimentales en nutrición ...
Podemos decir que la investigación nutricional es buena cuando sigue el método científico. Es importante examinar el tipo de experimento, que puede ser una investigación primaria o secundaria. La investigación primaria incluye estudios de laboratorio / animales, de casos y controles, de cohortes y aleatorizados. Cada tipo de investigación ...
Los estudios experimentales implican la manipulación de variables para establecer relaciones de causa y efecto. A menudo se llevan a cabo en entornos controlados, como laboratorios. ... Cada tipo de estudio en ciencias de la nutrición tiene su propio conjunto de fortalezas y limitaciones que pueden afectar la interpretación de los resultados.
Estudios Experimentales en Nutrición. Los estudios experimentales, también conocidos como estudios de intervención, están diseñados para probar los efectos de una intervención dietética específica en los resultados de salud. Los dos tipos principales de estudios experimentales son:
Estudio observacional: Estudiar los hábitos alimentarios de diferentes poblaciones para identificar posibles vínculos entre la nutrición y la prevalencia de enfermedades. Psicología : Estudio experimental : Realizar un experimento de laboratorio para probar el efecto de la privación del sueño en el rendimiento cognitivo controlando las ...
tales y experimentales, incluido el ensayo clínico aleato-rio, y, al final del espectro, el metaanálisis fruto de la revisión sistemática. Aunque el grado de evidencia cien- ... investigación nutricional, deberemos elegir el estudio más eficaz y eficiente para conseguir la respuesta más satisfactoria. En Nutrición Humana con frecuencia el
En un diseño experimental de ensayo clínico es lógico evaluar el estudio desde el punto de vista ético, pues todo estudio alberga un riesgo. Pero para la investigación clínica debería existir una norma que permitiera evaluar los datos de forma agregada y sin necesidad de pasar por el comité ético cuando hacemos constar en la historia ...
Los estudios experimentales se caracterizan por tener un grupo llamado «intervención», que se somete a un tratamiento, mientras que los estudios observacionales se caracterizan por observar y examinar la relación entre los factores específicos de un grupo de población y los factores o marcadores de salud o enfermedad 20. Por otro lado ...